题目内容
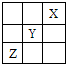 短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )| A、Z的最高化合价为+6价 |
| B、X的最高价氧化物的水化物是一种强酸 |
| C、1molY的单质跟足量水反应时,发生转移的电子为1mol |
| D、Z一定是活泼金属元素 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由短周期元素X、Y、Z在周期表中的位置关系图,则X为He,Y为F,Z为S,
A.S为第ⅥA族元素;
B.稀有气体不与氧气化合;
C.结合2F2+2H2O=4HF+O2分析;
D.硫为常见的非金属元素.
A.S为第ⅥA族元素;
B.稀有气体不与氧气化合;
C.结合2F2+2H2O=4HF+O2分析;
D.硫为常见的非金属元素.
解答:
解:由短周期元素X、Y、Z在周期表中的位置关系图,则X为He,Y为F,Z为S,
A.S为第ⅥA族元素,原子结构中最外层电子数为6,则Z的最高化合价为+6价,故A正确;
B.稀有气体不与氧气化合,则不存在X的最高价氧化物的水化物,故B错误;
C.由2F2+2H2O=4HF+O2可知,2molY的单质跟足量水反应时,转移4mol电子,则1molY的单质跟足量水反应时,发生转移的电子为2mol,故C错误;
D.Z为S元素,硫为常见的非金属元素,故D错误;
故选A.
A.S为第ⅥA族元素,原子结构中最外层电子数为6,则Z的最高化合价为+6价,故A正确;
B.稀有气体不与氧气化合,则不存在X的最高价氧化物的水化物,故B错误;
C.由2F2+2H2O=4HF+O2可知,2molY的单质跟足量水反应时,转移4mol电子,则1molY的单质跟足量水反应时,发生转移的电子为2mol,故C错误;
D.Z为S元素,硫为常见的非金属元素,故D错误;
故选A.
点评:本题考查位置、结构、性质的应用,为高频考点,把握短周期及相对位置确定X为He为解答的关键,选项B为解答的易错点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
某致基因突变物质的结构简式如图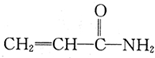 .下列相关分析正确的是( )
.下列相关分析正确的是( )
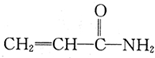 .下列相关分析正确的是( )
.下列相关分析正确的是( )| A、电负性:C<N<O |
| B、该分子中σ键与π键数目之比为4:2 |
| C、该分子所有原子处于同一平面 |
D、该分子的加聚产物为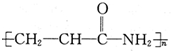 |
某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4(无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是( )
| A、一定没有CO2,肯定有H2 |
| B、一定有CO、CO2和水蒸气? |
| C、一定有H2、CO2和HCl |
| D、可能有CO2、NH3和水蒸气? |
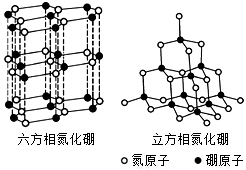 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.