题目内容
A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水.请回答下列问题:
(1)B的双原子阴离子电子式为 :用化学式表示一种由B、C、E组成的物质 .
(2)B的氢化物比E的氢化物的沸点 (填“高”或“低”),理由是 .
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式 .
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分.
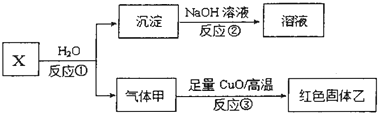
i.写出反应①的化学方程式 .
ii.若红色固体乙是一种单质,写出反应③的化学方稈式 .
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分 .
(1)B的双原子阴离子电子式为
(2)B的氢化物比E的氢化物的沸点
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分.

i.写出反应①的化学方程式
ii.若红色固体乙是一种单质,写出反应③的化学方稈式
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分
考点:位置结构性质的相互关系应用,无机物的推断
专题:推断题,元素周期律与元素周期表专题
分析:A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍,只能碳或硫,结合原子序数可知,A为碳;B能形成双原子阴离子,则B为O元素;B、E同主族,则E为S元素;C与B能形成两种常见的离子化合物,且C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,应是氢氧化铝与强酸、强碱的反应,则C为Na、D为Al,据此解答.
解答:
解:A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍,只能碳或硫,结合原子序数可知,A为碳;B能形成双原子阴离子,则B为O元素;B、E同主族,则E为S元素;C与B能形成两种常见的离子化合物,且C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,应是氢氧化铝与强酸、强碱的反应,则C为Na、D为Al,
(1)B的双原子阴离子为O22-,电子式为 ,由O、Na、S组成的物质有:Na2SO4、Na2SO3、Na2S2O4 等,
,由O、Na、S组成的物质有:Na2SO4、Na2SO3、Na2S2O4 等,
故答案为: ;Na2SO4、Na2SO3、Na2S2O4 (任意一种);
;Na2SO4、Na2SO3、Na2S2O4 (任意一种);
(2)水分子之间存在氢键,故沸点比硫化氢高,
故答案为:高;水分子之间存在氢键;
(3)O、Na、Al组成化合物为NaAlO2,其水溶液与过量CO2反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)气体甲是天然气的主要成分,则甲为CH4,X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,且X与水反应得到甲烷与沉淀,应是金属碳化物与水反应,可推知X为Al4C3,反应得到的沉淀为氢氧化铝,甲烷与CuO反应得到红色固体单质乙为Cu,根据电子转移守恒可知有二氧化碳生成,同时生成水,
i.反应①的化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑,
ii.反应③的化学方程式为:CH4+4CuO
4Cu+CO2+2H2O,
故答案为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑;CH4+4CuO
4Cu+CO2+2H2O;
(5)若某气体含有CO2和SO2中的一种或两种,请设计实验方案,探究该气体的成分,实验方案为:将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体,
故答案为:将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体.
(1)B的双原子阴离子为O22-,电子式为
 ,由O、Na、S组成的物质有:Na2SO4、Na2SO3、Na2S2O4 等,
,由O、Na、S组成的物质有:Na2SO4、Na2SO3、Na2S2O4 等,故答案为:
 ;Na2SO4、Na2SO3、Na2S2O4 (任意一种);
;Na2SO4、Na2SO3、Na2S2O4 (任意一种);(2)水分子之间存在氢键,故沸点比硫化氢高,
故答案为:高;水分子之间存在氢键;
(3)O、Na、Al组成化合物为NaAlO2,其水溶液与过量CO2反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)气体甲是天然气的主要成分,则甲为CH4,X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,且X与水反应得到甲烷与沉淀,应是金属碳化物与水反应,可推知X为Al4C3,反应得到的沉淀为氢氧化铝,甲烷与CuO反应得到红色固体单质乙为Cu,根据电子转移守恒可知有二氧化碳生成,同时生成水,
i.反应①的化学方程式为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑,
ii.反应③的化学方程式为:CH4+4CuO
| ||
故答案为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑;CH4+4CuO
| ||
(5)若某气体含有CO2和SO2中的一种或两种,请设计实验方案,探究该气体的成分,实验方案为:将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体,
故答案为:将气体依次通过盛有酸性高锰酸钾溶液、品红溶液、澄清石灰水的洗气瓶,若酸性高锰酸钾溶液褪色(或变浅),且品红不褪色、澄清石灰水变浑浊,为SO2、CO2的混合气体,若只有酸性高锰酸钾溶液褪色(或变浅),为SO2气体,若只有澄清石灰水变浑浊,为CO2气体.
点评:本题考查结构性质位置关系应用、无机物推断、实验方案设计等,(4)中X推断为易错点、难点,注意利用碳化钙进行迁移,难点中等.

练习册系列答案
相关题目
化学与人类生活密切相关,下列与化学有关的说法不正确的是( )
| A、开发和推广新能源是实现低碳生活的途径之一 |
| B、化学药品着火,要立即用水或泡沫灭火器灭火 |
| C、食品添加剂虽能改善食物味道等,但需限量使用 |
| D、化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 |
NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B、0.1mol 24Mg32S晶体中所含中子总数为2.8NA |
| C、常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4L |
| D、在熔融状态下,1mol NaHSO4完全电离出的阳离子数目为2NA |
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.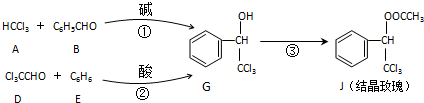
 +
+
 +H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为
+H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.