题目内容
(1)在下列变化中:①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水,未发生化学键破坏的是 ,仅发生离子键破坏的是 .(填写序号)
(2)下列五种物质中①Ne ②Na2O③NH3 ④KOH,只存在共价键的是 ,既存在共价键又存在离子键的是 .(填写序号)
(2)下列五种物质中①Ne ②Na2O③NH3 ④KOH,只存在共价键的是
考点:化学键,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:(1)依据发生的变化类别判断是否有化学键的破坏;依据物质所含有化学键的类型判断被破坏的键的类型;
(2)活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键;
共价化合物只含有共价键;离子化合物中可以含有共价键,一定含有离子键;
稀有气体为单原子分子不存在化学键.
(2)活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键;
共价化合物只含有共价键;离子化合物中可以含有共价键,一定含有离子键;
稀有气体为单原子分子不存在化学键.
解答:
解:(1)①碘的升华属于物理变化,破坏的是分子间作用力,未发生化学键的破坏; ②烧碱熔化过程过程中断裂离子钠离子与氢氧根离子之间的离子键;③MgCl2溶于水,断裂镁离子与氯离子之间的离子键;④HCl溶于水,断裂HCl分子中的共价键;
故答案为:①;②③;
(2)①Ne 为单原子分子,不存在化学键;
②Na2O中钠离子与阳离子之间形成离子键;
③NH3 氮原子和氢原子之间通过共用电子对形成共价键;
④KOH中钾离子与氢氧根离子之间存在离子键,氧原子与氢原子之间存在共价键;
所以只存在共价键的是③;既存在共价键又存在离子键的是④;
故答案为:③;④.
故答案为:①;②③;
(2)①Ne 为单原子分子,不存在化学键;
②Na2O中钠离子与阳离子之间形成离子键;
③NH3 氮原子和氢原子之间通过共用电子对形成共价键;
④KOH中钾离子与氢氧根离子之间存在离子键,氧原子与氢原子之间存在共价键;
所以只存在共价键的是③;既存在共价键又存在离子键的是④;
故答案为:③;④.
点评:本题考查了化学键的判断,以及化学键与化合物之间的关系,熟悉概念是解本题关键,注意并不是所有物质中都含有化学键,稀有气体为单原子分子,不含化学键,为易错点.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列判断错误的是( )
| A、稳定性:H2O>H2S>H2Se |
| B、半径:Na+>Mg2+>F- |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
取质量均为6.5g的两份锌粉a和b,分别加入100mL 2mol/L的稀硫酸中,并向a中加入少量CuSO4溶液,下列说法正确的是( )
| A、a比b 生成氢气的速率快,生成氢气的总量相同 |
| B、b比a 生成氢气的速率快,生成氢气的总量相同 |
| C、a比b 生成氢气的速率快,生成氢气的总量a比b多 |
| D、a比b 生成氢气的速率快,生成氢气的总量a比b少 |
下列各组中的离子或分子在指定溶液中一定能大量共存的是( )
| A、c(KNO3)=1.0mol/L的溶液中:Fe2+、Cl-、H+、Na+ | ||
| B、常温下,由水电离出的c(H+)=10-14mol/L溶液中:NH4+、CO32-、CH3COO-、SO42- | ||
| C、加入铝能产生大量氢气的溶液中:CH3CHO、MnO4-、K+、C6H5O- | ||
D、常温下,
|
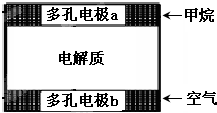 一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )
一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )| A、电极a反应式为:CH4+5O2--8e-=CO32-+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
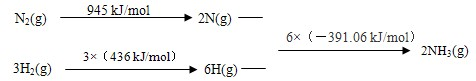
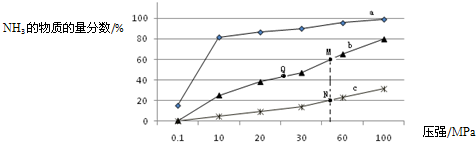
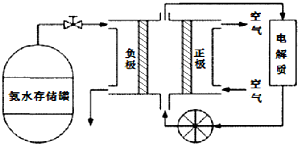
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.