题目内容
I.煤化工中常需研究不同溫度下平衡常数、投料比等问题.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K随温度的变化如下表:
回答下列问题
(1)该反应的平衡常数表达式K= ,△H= 0(填“<”、“>”、“=”)
(2)已知在一定温度下,CCs)+CO2(g)?2C0(g)平衡常数K1;C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2,则K、K1、K2之间的关系是 :
(3)800℃时,向一个10L的恒容反应器中充入0.40mol CO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CQ的转化率为 :若保持其他条件不变,向平衡体系中 再通入O.1Omol CO和O.40mol C02,此时v正 v逆 (填“>”、“=”或“<”).
Ⅱ.某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速>的影响”.
(4)向酸性KMn04溶液中加入一定量的H2C204溶液,当溶液中的KMn04耗尽后,紫色溶 液将褪去.为确保能观察到紫色褪去,H2C204与KMn04初始的物质的量需要满足的关系为n(H2C204):n(KMnO4) .
(5)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
表中x= mL,理由 .
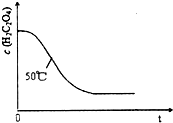
(6)已知50℃时,浓度c(H2C204)随反应时间t的变化曲线如图示,若保持其他条件不变,请在答题卡坐标图中画出25℃时c(H2C204)随t的变化曲线示意图.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)该反应的平衡常数表达式K=
(2)已知在一定温度下,CCs)+CO2(g)?2C0(g)平衡常数K1;C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2,则K、K1、K2之间的关系是
(3)800℃时,向一个10L的恒容反应器中充入0.40mol CO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CQ的转化率为
Ⅱ.某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速>的影响”.
(4)向酸性KMn04溶液中加入一定量的H2C204溶液,当溶液中的KMn04耗尽后,紫色溶 液将褪去.为确保能观察到紫色褪去,H2C204与KMn04初始的物质的量需要满足的关系为n(H2C204):n(KMnO4)
(5)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
(6)已知50℃时,浓度c(H2C204)随反应时间t的变化曲线如图示,若保持其他条件不变,请在答题卡坐标图中画出25℃时c(H2C204)随t的变化曲线示意图.

考点:化学平衡常数的含义,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)根据平衡常数的表达式推断;
(3)令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算,比较浓度商与平衡常数K的关系;
(4)根据化合价升降相等,来配平即可;
(5)研究反应物浓度对化学反应速率的影响,其条件不变的情况下只改变温度;
(6)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图.
(2)根据平衡常数的表达式推断;
(3)令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算,比较浓度商与平衡常数K的关系;
(4)根据化合价升降相等,来配平即可;
(5)研究反应物浓度对化学反应速率的影响,其条件不变的情况下只改变温度;
(6)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图.
解答:
解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,故K=
,升高温度,平衡常数减小,平衡逆向移动,故正反应为放热反应,
故答案为:(1)K=
;<;
(2)①C(s)+CO2(g)?2CO(g)平衡常数K1;
②C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2;
③CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K;③=②-①,故K=
,故答案为:K=
;
(3)对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.04 0.16 0 0
变化(mol/L):c c c c
平衡(mol/L):0.04-c 0.16-c c c
所以
=9,解得c=0.032
所以CO的转化率为
×100%=80%.
则平衡时各量为:
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.04 0.16 0 0
变化(mol/L) 0.032 0.032 0.032 0.032
平衡(mol/L):0.008 0.128 0.032 0.032
改变后的量为:CO(g)+H2O(g)?H2(g)+CO2(g),
改变后(mol/L):0.018 0.128 0.032 0.072
Qc=
=1=K,所以平衡不移动,
故答案为:80%;=;
(4)H2C204中碳由+3
+4价,升高1×2;
而锰由+7
+2,降低5价;升降守恒,所以最小公倍数为5;即n(H2C204):n(KMnO4)≥2.5,故答案为:≥2.5;
(5)只改变草酸的浓度,而混合溶液的体积不变,8+5-5-6=2mlL,对照实验,只改变其中的一个条件,故答案为:2;保证其它条件不变,只改变H2C2O4的浓度,从而达到对比的目的;
(6)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为: ,故答案为:
,故答案为: .
.
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
故答案为:(1)K=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
(2)①C(s)+CO2(g)?2CO(g)平衡常数K1;
②C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2;
③CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K;③=②-①,故K=
| K2 |
| K1 |
| K2 |
| K1 |
(3)对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.04 0.16 0 0
变化(mol/L):c c c c
平衡(mol/L):0.04-c 0.16-c c c
所以
| c×c |
| (0.04-c)×(0.16-c) |
所以CO的转化率为
| 0.032mol/L |
| 0.04mol/L |
则平衡时各量为:
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.04 0.16 0 0
变化(mol/L) 0.032 0.032 0.032 0.032
平衡(mol/L):0.008 0.128 0.032 0.032
改变后的量为:CO(g)+H2O(g)?H2(g)+CO2(g),
改变后(mol/L):0.018 0.128 0.032 0.072
Qc=
| 0.032×0.072 |
| 0.018 ×0.128 |
故答案为:80%;=;
(4)H2C204中碳由+3
| 变成 |
而锰由+7
| 变成 |
(5)只改变草酸的浓度,而混合溶液的体积不变,8+5-5-6=2mlL,对照实验,只改变其中的一个条件,故答案为:2;保证其它条件不变,只改变H2C2O4的浓度,从而达到对比的目的;
(6)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为:
 ,故答案为:
,故答案为: .
.
点评:本题考查了化学平衡常数,以反应的热效应,根据平衡常数求转化率,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
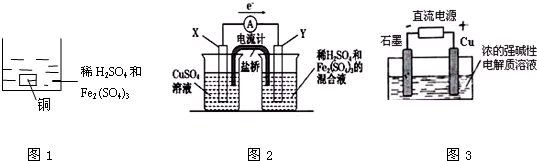

| A、如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L |
| B、如图2所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜 |
| C、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 |
| D、如图3所示,当有0.1mol电子转移时,有0.1mol Cu2O生成 |
化学与生活、生产、社会关系密切,下列叙述正确的是( )
| A、目前治理白色污染的方法主要是减少使用、加强回收 |
| B、少量钠、钾要在干燥的试剂瓶中保存妥善保管 |
| C、废旧电池应集中回收进行填埋处理 |
| D、柠檬是酸性食物 |
下列叙述正确的是( )
| A、汽油、柴油和植物油都属于烃 |
| B、乙醇既能被氧化为乙醛,也能被氧化为乙酸 |
| C、苯与溴水在Fe3+催化下发生取代反应生成溴苯 |
| D、硫酸铜溶液和硫酸铵溶液均可使蛋白质溶液变性 |
下列关于常温下电解质溶液的叙述中,正确的是( )
| A、向0.02mol?L-1 CH3COOH溶液中加入等体积0.01mol?L-1 NaOH溶液,测得溶液中c(CH3COO-)>c(Na+),则水的电离程度比纯水的大 |
| B、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=1×10-8mol?L-1 |
| C、等物质的量浓度的NH4Cl溶液和NH3?H2O溶液中,c(NH4+)前者小于后者 |
| D、等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |