题目内容
下列判断错误的是( )
| A、稳定性:H2O>H2S>H2Se |
| B、半径:Na+>Mg2+>F- |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.非金属性越强,气态氢化物越稳定;
B.具有相同电子排布的离子,原子序数大的离子半径小;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.金属性越强,对应最高价氧化物的水化物碱性越强.
B.具有相同电子排布的离子,原子序数大的离子半径小;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.金属性越强,对应最高价氧化物的水化物碱性越强.
解答:
解:A.非金属性O>S>Se,则气态氢化物的稳定性为H2O>H2S>H2Se,故A正确;
B.Na+、Mg2+、F-具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为F->Na+>Mg2+,故B错误;
C.非金属性Cl>S>P,对应最高价氧化物的水化物酸性为HClO4>H2SO4>H3PO4,故C正确;
D.金属性Na>Mg>Al,对应最高价氧化物的水化物碱性为NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选B.
B.Na+、Mg2+、F-具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为F->Na+>Mg2+,故B错误;
C.非金属性Cl>S>P,对应最高价氧化物的水化物酸性为HClO4>H2SO4>H3PO4,故C正确;
D.金属性Na>Mg>Al,对应最高价氧化物的水化物碱性为NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选B.
点评:本题考查金属性、非金属性的比较,为高频考点,把握元素的位置及元素周期律为解答的关键,注意常见的金属性、非金属性比较方法及应用,题目难度不大.

练习册系列答案
相关题目
下列离子在指定条件下一定能大量共存的是( )
| A、滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42- |
| B、与铝反应产生氢气的溶液中:Na+、AlO2-、NO3-、HCO3- |
| C、水电离产生的c(H+)=10-13 mol?L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D、0.1mol?L-1 HNO3溶液中:Mg2+、NH4+、Fe2+、Cl- |
已知一定条件下断裂或生成某些化学键的能量关系如下表:
请用此数据估计,由Cl2、H2生成1mol HCl时的热效应( )
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量 436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量 243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量 431kJ |
| A、放热183kJ |
| B、放热91.5kJ |
| C、吸热183kJ |
| D、吸热91.5kJ |
 利用如图所示装置可以模拟钢铁的电化学防护.下列说法正确的是( )
利用如图所示装置可以模拟钢铁的电化学防护.下列说法正确的是( )| A、若X为锌棒,开关K置于M处,铁极发生还原反应 |
| B、若X为碳棒,开关K置于N处,X极发生还原反应 |
| C、若X为碳棒,开关K置于N处,可加快铁的腐蚀 |
| D、若X为锌棒,开关K置于M处,可加快铁的腐蚀 |
下列叙述正确的是( )
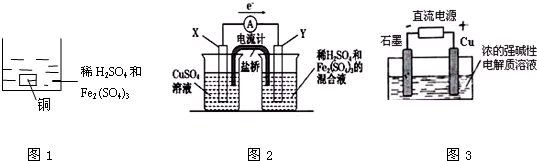

| A、如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L |
| B、如图2所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜 |
| C、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 |
| D、如图3所示,当有0.1mol电子转移时,有0.1mol Cu2O生成 |
下列各组物质中,互称为同位素的是( )
| A、氧气和臭氧 | ||||
B、
| ||||
| C、甲烷和乙烷 | ||||
| D、正丁烷和异丁烷 |
下列说法错误的是( )
| A、汽油燃烧产生的尾气中,含有碳的氧化物、氮的氧化物等污染物 |
| B、我国许多城市已经推广使用清洁燃料,如压缩天然气(CNG)类、液化石油气(LPG)类,这两类燃料的主要成分都是烃类 |
| C、光束通过下列分散系①有尘埃的空气②Fe(OH)3胶体③墨水④稀豆浆时,都能产生丁达尔效应 |
| D、114号元素在周期表中第七周期第ⅥA族,属于金属元素 |
下列说法正确的是( )
| A、等浓度的:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列顺序是①④②⑥③⑤ |
| B、标况下,将0.1mol?L-1的氨水溶液中加入氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C、饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH-;HPO42-?H++PO43-且溶液pH>7;加水稀释后溶液中HPO43-、PO43-、H+的浓度均减小 |