题目内容
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.
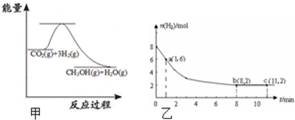
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.(1)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)如图甲表示该反应进行过程中能量的变化.该反应是
(2)某温度下,若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图乙实线所示(图中字母后的数字表示对应的坐标).在反应进行的0~1min内,该反应的速率v(H2)=
(3)下列各项中,不能够说明CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1mol CO2,同时生成1mol CH3OH
(4)16g液态甲醇(CH3OH)在氧气中完全燃烧生成二氧化碳和液态水,放出Q kJ的热量,写出甲醇燃烧的热化学方程式:
考点:反应热和焓变,热化学方程式,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)反应物能量高于生成物,反应放热;
(2)据图可知△c(H2),利用v(H2)=
求算;根据H2的物质的量的变化,求算;
(3)化学平衡状态判断的关键是v(正)=v(逆)和各组分的浓度保持不变,据此分析;
(4)16g甲醇即0.5mol,注意物质状态和△H的值与化学计量数的对应.
(2)据图可知△c(H2),利用v(H2)=
| △c(H2) |
| △t |
(3)化学平衡状态判断的关键是v(正)=v(逆)和各组分的浓度保持不变,据此分析;
(4)16g甲醇即0.5mol,注意物质状态和△H的值与化学计量数的对应.
解答:
解:(1)从图上可见,反应物能量高于生成物,反应放热,故答案为:放热;
(2)1min内,氢气的物质的量减少了2mol,v(H2)=
=
=1mol/(L?min);8min时,氢气反应了6mol,据化学方程式,CO2(g)+3H2(g)?CH3OH(g)+H2O(g),二氧化碳应反应2mol,剩余4mol,所以其浓度为:
=2mol/L,故答案为:1mol/(L?min);2;
(3)A、因反应前后的气体体积有变化,所以恒温、恒容条件下,容器内的压强不发生变化,说明反应达到了平衡状态,故A正确;
B、一定条件下,CH3OH分解的速率和CH3OH生成的速率相等说明v(正)=v(逆),反应达到了平衡状态,故B正确;
C、物质的浓度保持不变,说明反应达到了平衡状态,故C正确;
D、消耗CO2,同时生成 CH3OH都是指v(正),故D错误.
故选:D.
(4)16g甲醇即0.5mol,其燃烧放热为QKJ,所以其燃烧的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ?mol-1,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ?mol-1.
(2)1min内,氢气的物质的量减少了2mol,v(H2)=
| △c(H2) |
| △t |
| ||
| 1min |
| 4mol |
| 2L |
(3)A、因反应前后的气体体积有变化,所以恒温、恒容条件下,容器内的压强不发生变化,说明反应达到了平衡状态,故A正确;
B、一定条件下,CH3OH分解的速率和CH3OH生成的速率相等说明v(正)=v(逆),反应达到了平衡状态,故B正确;
C、物质的浓度保持不变,说明反应达到了平衡状态,故C正确;
D、消耗CO2,同时生成 CH3OH都是指v(正),故D错误.
故选:D.
(4)16g甲醇即0.5mol,其燃烧放热为QKJ,所以其燃烧的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ?mol-1,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ?mol-1.
点评:本题主要考查了化学反应速率的求算、化学平衡状态的判断和热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法错误的是( )
| A、汽油燃烧产生的尾气中,含有碳的氧化物、氮的氧化物等污染物 |
| B、我国许多城市已经推广使用清洁燃料,如压缩天然气(CNG)类、液化石油气(LPG)类,这两类燃料的主要成分都是烃类 |
| C、光束通过下列分散系①有尘埃的空气②Fe(OH)3胶体③墨水④稀豆浆时,都能产生丁达尔效应 |
| D、114号元素在周期表中第七周期第ⅥA族,属于金属元素 |
下列叙述正确的是( )
| A、汽油、柴油和植物油都属于烃 |
| B、乙醇既能被氧化为乙醛,也能被氧化为乙酸 |
| C、苯与溴水在Fe3+催化下发生取代反应生成溴苯 |
| D、硫酸铜溶液和硫酸铵溶液均可使蛋白质溶液变性 |
下列事实与氢键有关的是( )
| A、水结成冰体积膨胀,密度变小 |
| B、水加热到很高的温度都难以分解 |
| C、CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 |
| D、HF、HCl、HBr、HI的热稳定性依次减弱 |
下列说法正确的是( )
| A、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多量的CO2 |
| B、用0.1mol FeCl3配制成的1L溶液中,Fe3+的浓度为0.1mol?L-1 |
| C、用工业废弃物二氧化碳生产塑料,不会产生白色污染并有助于缓解温室效应 |
| D、工业生产硫酸中,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |
