题目内容
3.12.8gCu与足量浓硝酸反应,铜完全反应后,产生气体在标况下的体积为 4.48L,则消耗硝酸的物质的量为( )| A. | 0.20mol | B. | 0.40mol | C. | 0.42mol | D. | 0.60m |
分析 先根据n=$\frac{m}{M}$计算出铜的物质的量,反应消耗的硝酸分为两部分,一部分生成了硝酸铜,另一部分生成氮的氧化物,据此计算出消耗硝酸的总物质的量.
解答 解:12.8g铜的物质的量为:$\frac{12.8g}{64g/mol}$=0.2mol,由于铜完全反应,则反应生成硝酸铜的物质的量为0.2mol,生成硝酸铜消耗硝酸的物质的量为:0.2mol×2=0.4mol;反应消耗的硝酸中,根据N原子守恒,则一部分生成氮的氧化物消耗的硝酸为$\frac{4.48L}{22.4L/mol}$=0.2mol,所以消耗硝酸的总物质的量为:0.4mol+0.2mol=0.6mol,
故选D.
点评 本题考查了离子方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
5.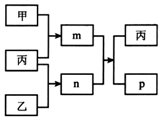 短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )
 短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙易溶于YW2,n为二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法一定正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 最简单氢化物的沸点:Z>W>Y | |
| C. | W的氧化物的水化物为强酸 | |
| D. | 常温常压下,X与Y组成的化合物为气体 |
6.m、n、p、q为原子序数依次增大的短周期主族元素.四种原子最外层电子数之和为18,n3-与p2+具有相同的电子层结构.下列叙述中错误的是( )
| A. | m、n、q一定是非金属元素 | |
| B. | 氢化物的沸点:q>n>m | |
| C. | 离子半径的大小:q>n>p | |
| D. | m与q形成的二元化合物一定是共价化合物 |
11.下列关于化学反应与能量的说法不正确的是( )
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |
8.下列生活中的问题,不能用金属晶体结构加以解释的是( )
| A. | 铁易生锈 | B. | 用金属铝制成导线 | ||
| C. | 用金箔做外包装 | D. | 用铁制品做炊具 |
15.下列有关化学用语表示正确的是( )
| A. | 氢氧根离子的电子式: | B. | NH4Br的电子式: | ||
| C. | Cl-的结构示意图: | D. | 过氧化钠的电子式: |
13.下列说法正确的是( )
| A. | 烷烃 名称为3,5-二甲基-4-乙基己烷 名称为3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物 CH3CH2CH(CH3)2 的一氯代物有 4 种 | |
| D. | 葡萄糖可以进一步水解成两分子乳酸 |


