题目内容
6.强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1:下面三个热化学方程式CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O (l);△H=-Q1kJ•mol-1
H2SO4(浓)+2NaOH(aq)═Na2SO4(aq)+2H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
分析 醋酸的电离吸热,浓硫酸稀释放热,中和反应为放热反应,以此来解答.
解答 解:由HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l)△H=-Q3 kJ•mol-1,可知Q3=57.3;
由CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O (l)△H=-Q1kJ•mol-1及醋酸电离吸热可知,该反应放出的热量减少,则Q1<57.3;
由H2SO4(浓)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-Q2 kJ•mol-1及浓硫酸稀释放热可知,该反应放出热量增加,则Q2>114.6,
综上所述,Q2>Q3>Q1,
故选C.
点评 本题考查反应热与焓变,为高频考点,把握中和热的意义及醋酸电离、浓硫酸稀释中的热效应为解答的关键,侧重分析与应用能力的考查,注意酸碱生成1mol水时的热量变化,题目难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
16.下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 | |
| B. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 | |
| C. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO${\;}_{3}^{-}$)+c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
17.化学与工农业生产、人类生活密切相关.下列说法中不正确的是( )
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
14.下列物质中,长期露置在空气中,不会变质的是( )
| A. | AgI | B. | 漂白粉 | C. | 食盐 | D. | 次氯酸钙溶液 |
1.现有部分元素的原子结构特点如表:
(1)画出W原子结构示意图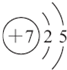 .
.
(2)元素X与元素Z相比,非金属性较强的是O(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2或2H2S+O2═2H2O+2S.
(3)X、Y、Z、W四种元素形成的一种化合物,其水溶液显强酸性,该化合物的化学式为NH4HSO4,写出其在水溶液中的电离方程式.NH4HSO4=NH4++H++SO42-
(4)元素X和元素Y以原子个数比1:1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等.以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式.N2H4+2H2O2$\frac{\underline{\;点燃\;}}{\;}$N2+4H2O.
| X | L层电子数是K层电子数的3倍 |
| Y | 核外电子层数等于原子序数 |
| Z | L层电子数是K层和M层电子数之和 |
| W | 共用三对电子形成双原子分子,常温下为气体单质 |
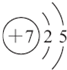 .
.(2)元素X与元素Z相比,非金属性较强的是O(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2或2H2S+O2═2H2O+2S.
(3)X、Y、Z、W四种元素形成的一种化合物,其水溶液显强酸性,该化合物的化学式为NH4HSO4,写出其在水溶液中的电离方程式.NH4HSO4=NH4++H++SO42-
(4)元素X和元素Y以原子个数比1:1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等.以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式.N2H4+2H2O2$\frac{\underline{\;点燃\;}}{\;}$N2+4H2O.
11.某有机物分子式为C5H10Cl2,其主链有4个碳原子的同分异构体共有多少种( )
| A. | 8 | B. | 9 | C. | 10 | D. | 11 |
18.用下列三种装置制备和收集CO2:将收集到的三瓶CO2分别置于天平上称量,若三个集气瓶体积相同、质量相等,则称量结果( )
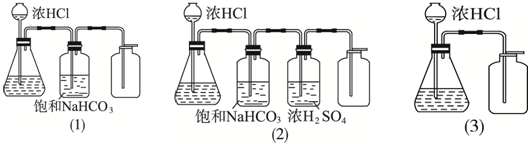

| A. | (1)(2)(3)一样重 | B. | (1)中最重 | C. | (2)中最重 | D. | (3)最轻 |
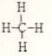 ;X、Z、N形成的原子个数比1:1:1的分子的电子式
;X、Z、N形成的原子个数比1:1:1的分子的电子式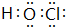 .
.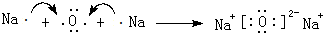 ;
;