题目内容
20.对于100mL1mol/L盐酸与铁片的反应,采取下列措施:①升高温度;②改用300mL1mol/L盐酸;③改用100mL3mol/L盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸.其中能使反应速率加快的是( )| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
分析 若要加快产生氢气的速率,可增大反应的浓度、增大固体的表面积、升高温度以及形成原电池反应,注意加入浓硫酸的性质,以此解答该题.
解答 解:①适当升高温度,增大活化分子百分数,反应速率加快,故正确;
②多用300mL 1mol/L盐酸,酸的浓度不变,反应速率不变,故错误;
③改用100mL 3mol/L盐酸,酸的浓度增大,反应速率加快,故正确;
④用等量铁粉代替铁片,增大固体接触面积,使反应速率加快,故正确;
⑤改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故错误;
综上所述,①③④正确;
故选A.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合运用的考查,难度不大,注意相关基础知识的积累,把握影响化学反应速率的因素.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
15.在pH=2的溶液中,下列各组离子可以大量共存的是( )
| A. | Ca2+、Al3+、HCO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | Na+、NH4+、Cl-、K+ |
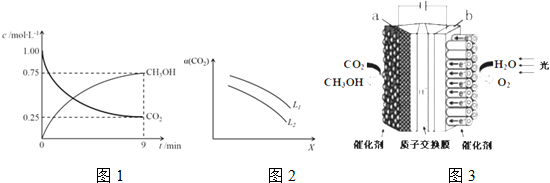
12. 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应放热 | |
| C. | 若相同温度下,上述容器容积可变,保持容器内压强不变,同样向容器中充入1 molCO2、3mol H2,则平衡时CO2的浓度与图中相同 | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
3.下列关于杂化轨道的叙述正确的是( )
| A. | 杂化轨道的数目、形状和参与杂化的原子轨道数目、形状均相同 | |
| B. | 等性杂化轨道的形状、能量相等; NH3中N是等性杂化 | |
| C. | 各杂化轨道在空间应满足电子对互斥理论,以使排斥力最小 | |
| D. | sp3杂化轨道应由同原子里能量相同的s和p轨道杂化而得 |