题目内容
15.在pH=2的溶液中,下列各组离子可以大量共存的是( )| A. | Ca2+、Al3+、HCO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | Na+、NH4+、Cl-、K+ |
分析 pH=2的溶液显酸性,根据离子之间不能解生成沉淀、气体、水等,不能发生相互促进水解反应等,则离子大量共存,以此来解答.
解答 解:A.酸性溶液中不能大量存在HCO3-,且Al3+、HCO3-相互促进水解不能共存,故A不选;
B.酸性溶液中该组离子之间不反应,可大量共存,故B选;
C.酸溶液中不能大量存在AlO2-、OH-,故C不选;
D.酸溶液中该组离子之间不反应,可大量共存,故D选;
故选BD.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.已知常温下:Ksp(AgCl)=1.8×10-10 mol2•L-2,Ksp(Ag2CrO4)=1.9×10-12 mol3•L-3,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
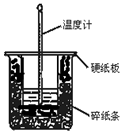 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题: