题目内容
10.有一包白色固体,可能含有NaCl,Na2SO4,BaCl2和Na2CO3中的一种或几种,为探究其成分,某同学做了如下实验:(1)将此白色固体取样,溶解于水,有白色沉淀生成;
(2)过滤出沉淀,并将沉淀移入试管中,加入稀盐酸,沉淀完全溶解并有气体生成;
(3)向上述滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解.
通过上述实验现象分析:该白色固体中一定含有的物质是BaCl2和Na2CO3,一定不含的物质是Na2SO4,不能确定的是NaCl,写出有关的反应方程式:①BaCl2+Na2CO3=BaCO3↓+2NaCl②BaCO3+2HCl=BaCl2+CO2↑+H2O,③BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2.
分析 (1)将此白色固体取样,溶解于水,有白色沉淀生成,白色沉淀为碳酸钡或硫酸钡,则一定含BaCl2;
(2)过滤出沉淀,并将沉淀移入试管中,加入稀盐酸,沉淀完全溶解并有气体生成,可知沉淀只有碳酸钡,则一定含Na2CO3,不含Na2SO4;
(3)向上述滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,白色沉淀为AgCl,氯化钡含氯离子,不能确定是否含NaCl,以此来解答.
解答 解:(1)将此白色固体取样,溶解于水,有白色沉淀生成,白色沉淀为碳酸钡或硫酸钡,则一定含BaCl2;
(2)过滤出沉淀,并将沉淀移入试管中,加入稀盐酸,沉淀完全溶解并有气体生成,可知沉淀只有碳酸钡,则一定含Na2CO3,不含Na2SO4;
(3)向上述滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,白色沉淀为AgCl,氯化钡含氯离子,不能确定是否含NaCl,
综上所述,一定含BaCl2和Na2CO3,一定不含的物质是Na2SO4,不能确定的是NaCl,①中发生反应为BaCl2+Na2CO3=BaCO3↓+2NaCl,②中发生反应为BaCO3+2HCl=BaCl2+CO2↑+H2O,③中发生反应为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2,
故答案为:BaCl2和Na2CO3;Na2SO4;NaCl;BaCl2+Na2CO3=BaCO3↓+2NaCl;BaCO3+2HCl=BaCl2+CO2↑+H2O;BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意白色沉淀的判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,22.4LCO2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
2.如图所示,下列说法正确的是( )
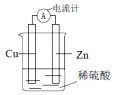

| A. | 该装置中能量转化方式为电能转化为化学能 | |
| B. | 电子从锌片流出,经导线流向铜片 | |
| C. | 工作一段时间之后,溶液颜色逐渐变蓝 | |
| D. | 锌片发生还原反应 |
19.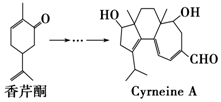 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )| A. | 香芹酮化学式为C10H14O | |
| B. | CyrneineA可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和CyrneineA均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
 .
.