题目内容
19.将0.01mol的铁、铝混合物溶于100mL 0.2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=16mL时,则V2为( )
| A. | 24mL | B. | 30mL | C. | 440mL | D. | 44mL |
分析 根据图象可知,在滴加NaOH溶液到体积V1=16mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=16mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg)、n(Al);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=$\frac{n}{c}$计算滴入氢氧化钠溶液体积V2.
解答 解:当V1=16mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.016L×1mol/L=0.008mol,
设MgSO4为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.01,
100mL 0.2mol/L的H2SO4溶液中含有硫酸的物质的量为:0.2mol/L×0.1L=0.02mol,
根据SO42-离子守恒有:x+3y=0.02-0.008=0.012,
联立方程解得:x=0.006、y=0.002,
所以金属粉末中:n(Mg)=0.006mol,n(Al)=2y=2×0.02mol=0.004mol,
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.02mol+0.004mol=0.044mol,
则V2=$\frac{0.044mol}{1mol/L}$=0.044L=44mL,
故选D.
点评 本题考查了有关混合物反应的计算,题目难度中等,明确图象曲线变化的含义为解答此类题的关键,注意掌握常见离子的性质及发生的反应,试题有利于培养学生的分析、理解能力及化学计算能力.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 下列说法不正确的是( )
下列说法不正确的是( )| A. | 该药物在人体胃液中能发生水解反应 | |
| B. | 其水解产物中可能有乙二醇 | |
| C. | 其水解产物中可能有芳香族化合物 | |
| D. | 该高分子化合物通过缩聚反应得到 |
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液.
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:溶液由红色变无色,半分钟内无颜色变化
(2)有关数据记录如下:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 6.00 | 25.95 |
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果无影响
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果偏高
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果偏低.
| A. | 硅酸钠可用于制备硅胶和木材防火剂等 | |
| B. | 氧化铝熔点高可用作耐火材料 | |
| C. | 晶体硅可用于制造光导纤维 | |
| D. | 氯水和臭氧可用于自来水消毒 |
| A. | 氧化性:KMnO4<Cl2 | |
| B. | 500mL12.8mol/L的盐酸与足量的KMnO4反应,可生成1.6 molCl2 | |
| C. | 此反应中氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 实验室使用硫酸而不用盐酸酸化高锰酸钾,因为盐酸会被高锰酸钾氧化 |
| A. | 摩尔质量:g?mol-1 | B. | 气体摩尔体积:L | ||
| C. | 物质的量:mol | D. | 物质的量浓度:mol?L-1 |
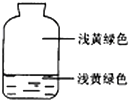 向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )| A. | AgNO3溶液 | B. | NaOH溶液 | C. | 水 | D. | 石蕊溶液 |