题目内容
4.A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下所示(反应条件及其他物质已经略去):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D.(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红,则A为NH3.写出A→B转化的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则C是Na2O2.A跟水发生反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑.
分析 (1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红,则A为NH3,B为NO,C为NO2,D为HNO3;
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A为Na、B为Na2O、C为Na2O2、D为NaOH.
解答 解:(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红,则A为NH3,B为NO,C为NO2,D为HNO3,A→B转化的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NH3;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A为Na、B为Na2O、C为Na2O2、D为NaOH,钠跟水发生反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,
故答案为:Na2O2;2Na+2H2O═2Na++2OH-+H2↑.
点评 本题考查无机物推断,侧重于学生的分析能力的考查,难度中等,需要学生熟练掌握元素化合物知识,注意掌握中学常见连续氧化反应.

练习册系列答案
相关题目
15.人们已步入“4G”时代,以光导纤维为基础的高速信息通道尤为重要.制造光导纤维的材料是( )
| A. | 铜合金 | B. | 橡胶 | C. | 聚乙烯 | D. | 二氧化硅 |
12.下列实验方法正确的是( )
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 某气体能使品红溶液褪色,该气体一定为SO2 | |
| C. | 用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| D. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
19.将0.01mol的铁、铝混合物溶于100mL 0.2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=16mL时,则V2为( )

| A. | 24mL | B. | 30mL | C. | 440mL | D. | 44mL |
16.已知离子方程式:As2S3+H2O+NO3-→AsO43-+SO42-+NO↑+( )□(未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
| A. | 配平后水的化学计量数为4 | |
| B. | 反应后溶液呈酸性 | |
| C. | 配平后氧化剂与还原剂的物质的量之比为3:28 | |
| D. | 氧化产物为AsO43-和SO42- |
13.随着卤素原子序数递增,下列说法正确的是( )
| A. | 单质的熔、沸点逐渐降低 | B. | 单质的氧化性逐渐减弱 | ||
| C. | 阴离子的还原性逐渐减弱 | D. | 气态氢化物稳定性逐渐增强 |
14.孔雀石的主要成分为Cu2(OH)2CO3,还含少量二价铁和三价铁的氧化物及硅的氧化物.以下是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图:
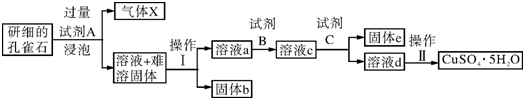
(1)试剂A的化学式是H2SO4;操作Ⅰ的名称是过滤;
(2)生成气体X的化学方程式为:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:
①试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离.试剂C宜选用D:
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7-4.8.
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去.

(1)试剂A的化学式是H2SO4;操作Ⅰ的名称是过滤;
(2)生成气体X的化学方程式为:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7-4.8.
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去.
