题目内容
11.如图所示,甲池的总反应式为:CH4+2O2+2KOU=K2CO3+3H2O,下列说法正确的是( )
| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池中正极的电极反应式是O2+4e-+4H+=2H2O | |
| C. | 反应过程中,乙池的pH逐渐减小 | |
| D. | 甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1:2 |
分析 根据反应方程式知,甲装置是燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极;乙、丙有外加电源,所以是电解池,石墨与原电池的正极相连,所以B石墨电极是阳极,Ag为阴极,阴极上铜离子得电子生成Cu,丙中左边的电极为阳极,右边的电极为阴极,结合电极反应方程式分析.
解答 解:A.甲池是原电池,是化学能转化为电能的装置,乙、丙池是电解池,是电能转化电能的装置,故A错误;
B.在燃料电池中,正极是氧气发生得电子的还原反应,在碱性电解质下的电极反应为O2+4e-+2H2O=4OH-,故B错误;
C.电解池乙池中,电解后生成硫酸、铜和氧气,溶液中氢离子浓度增大,则pH逐渐减小,故C正确;
D.甲池中消耗1molO2,则转移电子4mol,根据转移电子守恒知,丙中生成的氢气和氯气各为2mol,则甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1:4,故D错误;
故选C.
点评 本题考查原电池和电解池原理,题目难度中等,注意把握燃料电池原理和电解原理,注意书写电极反应式时要结合电解质溶液的酸碱性,电解质溶液不同电极反应式不同,侧重于考查学生对基础知识的应用能力

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
2.Al可以与稀硝酸反应,已知HNO3被还原为N2O.若标准状况有3.36LN2O生成.则参加反应的Al的质量(g)为( )
| A. | 27 | B. | 5.4 | C. | 10.8 | D. | 16.2 |
19.已知:氯化银、溴化银、硫化银的Ksp分别为1.56×10-10、7.7×10-13、6.3×10-50,某溶液中含有浓度均为 0.01mol/L 的Cl-、Br-、S2-,向该溶液中逐滴滴加0.01mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序是( )
| A. | Cl-、Br-、S2- | B. | Br-、Cl-、S2- | C. | S2-、Br-、Cl- | D. | Br-、S2-、Cl- |
6.甲烷的燃烧热为△H1,氢气的燃烧热为△H2,且△Hl<△H2,若甲烷和氢气的混合物1mol完全燃烧生成稳定的化合物时,反应热为△H3,则甲烷和氢气的物质的量之比为( )
| A. | $\frac{△{H}_{3-}△{H}_{2}}{△{H}_{3-}△{H}_{2}}$ | B. | $\frac{△{H}_{2-}△{H}_{3}}{△{H}_{3-}△{H}_{1}}$ | ||
| C. | $\frac{△{H}_{2}-△{H}_{3}}{△{H}_{1}-△{H}_{3}}$ | D. | $\frac{△{H}_{3}-△{H}_{1}}{△{H}_{2}-△{H}_{3}}$ |
16.某课外实验小组设计的下列实验不合理的是( )


| A. | 图1:制备并观察氢氧化亚铁 | B. | 图2:证明过氧化钠与水反应放热 | ||
| C. | 图3:收集二氧化氮气体 | D. | 图4:制备氨气 |
20.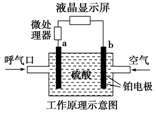 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )| A. | b为正极,电极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解质溶液中的H+移向a电极 | |
| C. | 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 | |
| D. | 呼出气体中酒精含量越高,微处理器中通过的电流越小 |
1.食醋是厨房中常用的调味剂,利用食醋能完成的实验是( )
| A. | 检验自来水中是否含有氯离子 | B. | 检验土豆中是否含有淀粉 | ||
| C. | 检验鸡蛋中是否含有碳酸钙 | D. | 检验无水酒精中是否含水 |


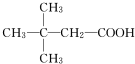 .(用结构简式表示)
.(用结构简式表示)