题目内容
9.反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O中,还原产物是( )| A. | CuSO4 | B. | H2SO4 | C. | H2O | D. | SO2 |
分析 在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,得电子被还原,以此解答该题.
解答 解:在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,得电子被还原,则氧化剂是H2SO4,还原剂是Cu,氧化产物是CuSO4,还原产物是SO2,
故选D.
点评 本题考查氧化还原反应知识,为高考常见考点,侧重于学生的分析能力和基本概念的理解和应用的考查,注意把握元素化合价的变化为解答该题的关键,难度不大.

练习册系列答案
相关题目
20.下列所述的操作中没有涉及到化学变化的是( )
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 熟石膏转化为生石膏 | |
| D. | 工业制液态氧 |
17.用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 12g 12C含中子数为NA | |
| B. | 标准状况下,22.4L氖气中含有原子数为2NA | |
| C. | 28g CO和N2混合气体含有的原子数为2NA | |
| D. | 2mol钠与足量O2完全反应生成Na2O2时失去电子数为NA |
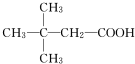
4. 某有机物的结构为如图所示,这种有机物不可能具有的性质是( )
某有机物的结构为如图所示,这种有机物不可能具有的性质是( )
①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生水解反应.
 某有机物的结构为如图所示,这种有机物不可能具有的性质是( )
某有机物的结构为如图所示,这种有机物不可能具有的性质是( )①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生水解反应.
| A. | ①④ | B. | 只有⑤ | C. | ②⑤ | D. | ④⑤ |
14.下列药品中,具有解热镇痛作用,可用作治疗感冒的是( )
| A. | 阿司匹林 | B. | 青霉素 | C. | 麻黄碱 | D. | 抗酸药 |
18.化学与社会、生活密切相关.对下列现象或事实的解释不正确的是( )
| 选项 | 现象或事实 | 解释或对应的离子方程式 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 酸雨样品在空气中放置pH减小 | 亚硫酸被氧化为硫酸 2H2SO3+O2=2H2SO4 |
| C | “84”消毒液具有漂白性 | ClO-+CO2+H2O=HClO+HCO3- |
| D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
| A. | A | B. | B | C. | C | D. | D |
19.已知:氯化银、溴化银、硫化银的Ksp分别为1.56×10-10、7.7×10-13、6.3×10-50,某溶液中含有浓度均为 0.01mol/L 的Cl-、Br-、S2-,向该溶液中逐滴滴加0.01mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序是( )
| A. | Cl-、Br-、S2- | B. | Br-、Cl-、S2- | C. | S2-、Br-、Cl- | D. | Br-、S2-、Cl- |
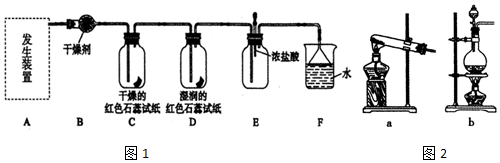


 .(用结构简式表示)
.(用结构简式表示)