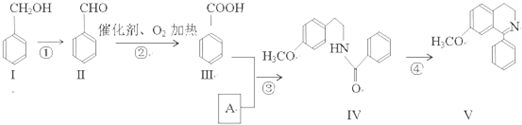
题目内容
W、X、Y、Z均是短周期主族元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高价氧化物对应的水化物与其氢化物能反应生成盐,X的氧化物既能溶于酸又能溶于碱,Y的最高正价与最低负价的代数和为O.下列说法正确的是( )
| A、离子半径:W>X>Z |
| B、原子半径:Z>X>Y |
| C、单质的熔点:W>Z>Y |
| D、最高正价:Z>W>X |
考点:原子结构与元素周期律的关系
专题:
分析:W、X、Y、Z均是短周期主族元素,W的最高价氧化物对应的水化物与其氢化物能反应生成盐,则W为N元素;X的氧化物既能溶于酸又能溶于碱,则X为Al;X、Y、Z处于同一周期,即均处于第三周期,Y的最高正价与最低负价的代数和为0,故Y为Si元素;W、X、Z的简单离子具有相同的电子层结构,则Z为Na或Mg,据此解答.
解答:
解:W、X、Y、Z均是短周期主族元素,W的最高价氧化物对应的水化物与其氢化物能反应生成盐,则W为N元素;X的氧化物既能溶于酸又能溶于碱,则X为Al;X、Y、Z处于同一周期,即均处于第三周期,Y的最高正价与最低负价的代数和为0,故Y为Si元素;W、X、Z的简单离子具有相同的电子层结构,则Z为Na或Mg.
A.电子层结构相同,核电荷数越大离子半径越小,故离子半径:W>Z>X,故A错误;
B.同周期自左而右原子半径减小,故原子半径,Z>X>Y,故B正确;
C.W单质为氮气,属于分子晶体,Z单质为Na或Mg,Y单质为原子晶体,沸点Y>Z>W,故C错误;
D.Z的最高正价为+1或+2,W的最高正价为+5,X的最高正价为+3,故最高正价:W>X>Y,故D错误,
故选B.
A.电子层结构相同,核电荷数越大离子半径越小,故离子半径:W>Z>X,故A错误;
B.同周期自左而右原子半径减小,故原子半径,Z>X>Y,故B正确;
C.W单质为氮气,属于分子晶体,Z单质为Na或Mg,Y单质为原子晶体,沸点Y>Z>W,故C错误;
D.Z的最高正价为+1或+2,W的最高正价为+5,X的最高正价为+3,故最高正价:W>X>Y,故D错误,
故选B.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律理解掌握,注意Z的不确定性.

练习册系列答案
相关题目
氢原子的3d和4s能级的能量高低是( )
| A、3d>4s |
| B、3d<4s |
| C、3d=4s |
| D、无3d、4s轨道,无所谓能量高低 |
下列有关能量转化的说法中正确的是( )
| A、铝热反应属于吸热反应 | ||||
| B、“H-CI→H+C1“过程中放出热量 | ||||
| C、干冰升华过程放出热量 | ||||
D、 反应“C+H2O
|
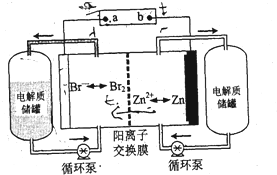 锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )| A、充电时电极b连接电源的正极 |
| B、放电时正极的电极反应式为Zn-2e-=Zn2+ |
| C、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| D、充电时左侧电解质储罐中的离子总浓度增大 |
如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误是( )
| X | A | ||
| Y | C | B |
| A、原子半径大小:Y>C>X>A |
| B、Y和B形成的化合物中Y和B的原子个数比为2:3 |
| C、X、C、A中最高价氧化物对应的水化物的酸性最强的是A |
| D、A、B均为非金属元素,所以两者的氢化物相遇不发生反应 |
下列解释事实的方程式不正确的是( )
| A、向NaHCO3溶液中加入NaOH溶液:HCO3-+OH-═CO2↑+H2O | ||||
| B、盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O | ||||
C、为减少煤燃烧产生SO2,用CaCO3脱硫:2CaCO3+O2+2SO2
| ||||
| D、向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |