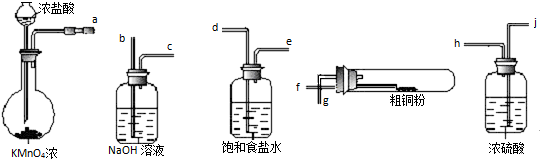
��Ŀ����
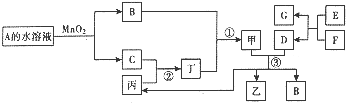 ��֪������A��B�����붡�����Ԫ����ͬ�������������ж�����ͬһ��Ԫ�أ�A��B�ڳ����³�Һ̬��D��FΪ�����������ʣ���D��F�ֱ����Ũ��Һ�ֱ��ڳ������ö�������������ʱ���д������������E��һ�ֺ���ɫ��ĩ��A����ɻ������ɼף��ҡ�����B�ڳ�����Ҳ�������ɼ���һ�ֻ�����X���䲿��ת����ϵ��ͼ�����ת���в��ַ�Ӧ������������δ�������
��֪������A��B�����붡�����Ԫ����ͬ�������������ж�����ͬһ��Ԫ�أ�A��B�ڳ����³�Һ̬��D��FΪ�����������ʣ���D��F�ֱ����Ũ��Һ�ֱ��ڳ������ö�������������ʱ���д������������E��һ�ֺ���ɫ��ĩ��A����ɻ������ɼף��ҡ�����B�ڳ�����Ҳ�������ɼ���һ�ֻ�����X���䲿��ת����ϵ��ͼ�����ת���в��ַ�Ӧ������������δ���������1��A�ķ���ʽΪ
��2��д����Ӧ�۵Ļ�ѧ����ʽΪ
��3������Һ�и����ӵ�Ũ�ȴ�С��ϵΪ
��4����������1.2mol X��ˮ��Һ�������ԣ�ͨ������C��ַ�Ӧ�����ɺ��ɫ��������Һ���ػ�ɫ����д����Ӧ�Ļ�ѧ����ʽ
���㣺������ƶ�
ר�⣺
������A��B�ڳ����¾���Һ̬����ת����ϵ��֪��AΪH2O2��BΪH2O��CΪO2��D��F��Ϊ�����������ʣ���D��F���Ũ��Һ�ڳ������ö�������������Ϊ�����ۻ���Ӧ����F���û�����D����FΪAl��DΪFe��Ϊ���ȷ�Ӧ��E��һ�ֺ���ɫ��ĩ��EΪFe2O3��A������Ի������ɼף���֪��Ϊ���ᣬ��ΪSO2����ΪSO3����ΪFe2��SO4��3��XΪFeSO4����϶�Ӧ���ʵ������Լ���ĿҪ������⣮
���
�⣺A��B�ڳ����¾���Һ̬����ת����ϵ��֪��AΪH2O2��BΪH2O��CΪO2��D��F��Ϊ�����������ʣ���D��F���Ũ��Һ�ڳ������ö�������������Ϊ�����ۻ���Ӧ����F���û�����D����FΪAl��DΪFe��Ϊ���ȷ�Ӧ��E��һ�ֺ���ɫ��ĩ��EΪFe2O3��A������Ի������ɼף���֪��Ϊ���ᣬ��ΪSO2����ΪSO3����ΪFe2��SO4��3��XΪFeSO4��
��1��A�ķ���ʽΪH2O2��E�Ļ�ѧʽΪFe2O3���ʴ�Ϊ��H2O2�� Fe2O3��
��2����Ӧ�۵Ļ�ѧ����ʽΪ2Fe+6H2SO4��Ũ��
Fe2��SO4��3+3SO2��+6H2O���ʴ�Ϊ��2Fe+6H2SO4��Ũ��
Fe2��SO4��3+3SO2��+6H2O��
��3����3��Fe2��SO4��3��ˮ������ԣ�����Ũ�ȴ�СΪc��SO42-����c��Fe3+����c��H+����c��OH-����
�ʴ�Ϊ��c��SO42-����c��Fe3+����c��H+����c��OH-����
��4������������Һ��ͨ��������ַ�Ӧ����������������������������Ӧ����ʽΪ12 FeSO4+3 O2+6 H2O�T4 Fe��OH��3��+4 Fe2��SO4��3��
XΪFeSO4��ͨ�����������ɺ��ɫ��������Һ���ػ�ɫ�����õ�Fe��OH��3��Fe2��SO4��3���������غ��֪1.2molFeSO4������0.4molFe��OH��3��0.4molFe2��SO4��3��0.4molFe��OH��3���շֽ�ɵõ�0.2molFe2O3������Ϊ0.2mol��160g/mol=32g��
�ʴ�Ϊ��12 FeSO4+3 O2+6 H2O�T4 Fe��OH��3��+4 Fe2��SO4��3��32g��
��1��A�ķ���ʽΪH2O2��E�Ļ�ѧʽΪFe2O3���ʴ�Ϊ��H2O2�� Fe2O3��
��2����Ӧ�۵Ļ�ѧ����ʽΪ2Fe+6H2SO4��Ũ��
| ||
| ||
��3����3��Fe2��SO4��3��ˮ������ԣ�����Ũ�ȴ�СΪc��SO42-����c��Fe3+����c��H+����c��OH-����
�ʴ�Ϊ��c��SO42-����c��Fe3+����c��H+����c��OH-����
��4������������Һ��ͨ��������ַ�Ӧ����������������������������Ӧ����ʽΪ12 FeSO4+3 O2+6 H2O�T4 Fe��OH��3��+4 Fe2��SO4��3��
XΪFeSO4��ͨ�����������ɺ��ɫ��������Һ���ػ�ɫ�����õ�Fe��OH��3��Fe2��SO4��3���������غ��֪1.2molFeSO4������0.4molFe��OH��3��0.4molFe2��SO4��3��0.4molFe��OH��3���շֽ�ɵõ�0.2molFe2O3������Ϊ0.2mol��160g/mol=32g��
�ʴ�Ϊ��12 FeSO4+3 O2+6 H2O�T4 Fe��OH��3��+4 Fe2��SO4��3��32g��
���������⿼��������ƶϣ�������ѧ���ķ��������ͼ��������Ŀ��飬Ϊ�߿��������ͣ��Ѷ��еȣ�ע��������ʵ����ʡ���;��������Ϊ������Ĺؼ���

��ϰ��ϵ�д�
�����Ŀ
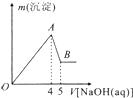 ����AlCl3��MgSO4�Ļ����Һ�������в��ϼ���NaOH��Һ�õ��ij������������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ����ԭ��Һ��Cl-��SO42-�����ʵ���֮��Ϊ��������
����AlCl3��MgSO4�Ļ����Һ�������в��ϼ���NaOH��Һ�õ��ij������������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ����ԭ��Һ��Cl-��SO42-�����ʵ���֮��Ϊ��������| A��1��1 | B��3��2 |
| C��3��1 | D��6��1 |
ij��ɫ��Һ�м�����������г������������˺�����Һ�м��������ˮ���г���������������Һ�з����������ǣ�������
| A��Ag+��Al3+��Fe3+ |
| B��SiO32-��[Al��OH��4]-��K+ |
| C��Ag+��Cu2+��Na+ |
| D��Ag+��Ba2+��Na+ |
ʵ������Cl2��ӦΪ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O��������˵������ȷ���ǣ�������
| ||
| A����ԭ����HCl����������MnO2 |
| B��Cl2���������������ǻ�ԭ���� |
| C��ÿ����1molCl2ת�Ƶ��ӵ����ʵ���Ϊ2mol |
| D��ÿ����1molCl2��2molHCl������ |
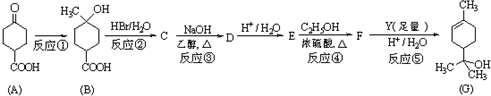
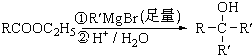
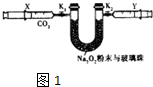 ��1����ͼ1ע����X�г�ȡ100mL CO2��U�ι���װ������С�������Լ1.5gNa2O2��ĩ����K1��K2ֹˮ�У�������CO2ѹ��U�ι��У��۲쵽��ʵ��������
��1����ͼ1ע����X�г�ȡ100mL CO2��U�ι���װ������С�������Լ1.5gNa2O2��ĩ����K1��K2ֹˮ�У�������CO2ѹ��U�ι��У��۲쵽��ʵ��������