题目内容
13.写出下列物质的电子式:氨分子
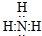 ,氯化铵
,氯化铵 .
.试用方程式表示氨溶于水呈碱性的原理:氨气和水反应生成一水合氨,一水合氨部分电离生成氢氧根离子,NH3•H2O?NH4++OH-,溶液显碱性.
分析 首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构,氨气中存在3个氮氢键,氮原子最外层8个电子,氯化铵为离子化合物,复杂阳离子和阴离子均需要括号,氨气和水反应生成一水合氨,一水合氨部分电离生成氢氧根离子.
解答 解:氨气中存在3个氮氢键,氮原子最外层8个电子,氨气的电子式为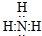 ,氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
,氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,
,
氨气和水反应生成一水合氨,一水合氨部分电离生成氢氧根离子,溶液显碱性,电离方程式为:NH3•H2O?NH4++OH-,
故答案为: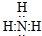 ;
; ;氨气和水反应生成一水合氨,一水合氨部分电离生成氢氧根离子,NH3•H2O?NH4++OH-,溶液显碱性.
;氨气和水反应生成一水合氨,一水合氨部分电离生成氢氧根离子,NH3•H2O?NH4++OH-,溶液显碱性.
点评 本题考查了电子式的书写、电离平衡,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
3.在下列氧化还原反应中,水既不作氧化剂又不作还原剂的是( )
①2Na+2H2O=2NaOH+H2↑
②2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
③2F2+2H2O=O2+4HF
④3NO2+H2O=2HNO3+NO
⑤NaH+H2O=NaOH+H2↑
⑥2Na2O2+2H2O=4NaOH+O2↑
①2Na+2H2O=2NaOH+H2↑
②2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
③2F2+2H2O=O2+4HF
④3NO2+H2O=2HNO3+NO
⑤NaH+H2O=NaOH+H2↑
⑥2Na2O2+2H2O=4NaOH+O2↑
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②③⑤ | D. | ④⑥ |
4.下列有关物质的量和摩尔质量的叙述,正确的是( )
| A. | 水的摩尔质量是18 g | |
| B. | 0.012 Kg 12C中约含有6.02×1023个碳原子 | |
| C. | 1 mol水中含有2 mol氢和1 mol氧 | |
| D. | 1 mol任何物质都含有6.02×1023个分子 |
1.一定条件下,在体积为10L的密闭容器中,1molA和1molB进行反应:2A(g)+B(g)?2C(g),达到平衡时生成0.6molC.下列说法正确的是( )
| A. | 当容器内密度保持不变时,可以判断反应已达平衡 | |
| B. | 其他条件不变,将容器体积变为5L,C的平衡浓度变为原来的2倍 | |
| C. | 其他条件不变.若增大压强,则物质A的转化率减小 | |
| D. | 达到平衡时,C的体积百分含量为35.3% |
8.下列离子方程式中正确的是( )
| A. | 少量SO2通入过量氨水中:NH3•H2O+SO2→HSO3-+NH4+ | |
| B. | H2S通入氯水中:S2-+Cl2→S↓+2Cl- | |
| C. | 二氧化氮溶于水:3NO2+H2O→2H++2NO3-+NO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O |
5.在测定硫酸铜晶体结晶水含量的试验中,以下操作会使测定结果偏高的是( )
| A. | 晶体中含有受热不分解的杂质 | |
| B. | 加热过程中有少量晶体爆溅损失 | |
| C. | 加热后未放入干燥器中冷却 | |
| D. | 加热时未进行搅拌,看到固体边缘变白就停止加热 |
14.在恒温恒容密闭容器中,不能说明反应2NO2(g)?2NO(g)+O2(g)达到平衡状态的是( )
| A. | NO2、NO、O2的物质的量之比是2:1:1 | |
| B. | 单位时间内生成1mol O2的同时生成2mol NO2 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的平均相对分子质量不再改变的状态 |
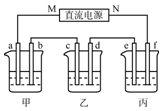 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.