题目内容
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
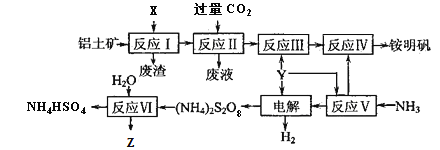
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
【答案】 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 1×10-5 蒸发浓缩 冷却结晶 2SO42-—2e-= S2O82- (NH4)2S2O8+2H2O = 2NH4HSO4+H2O2 S2O82- + 2H2O + Mn 2+=4H+ + 2SO42- + MnO2↓ 锰的化合物可催化H2O2的分解,使消耗的H2O2增多
【解析】(1)氧化铝与强碱溶液反应生成偏铝酸盐溶液,向溶液中通入足量二氧化碳气体生成氢氧化铝和碳酸氢盐,离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;正确答案:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(2)根据题意可知,设溶液的体积均为1L,氨水和硫酸恰好完全反应生成硫酸铵0.1mol,根据水解反应NH4++H2O![]() NH3H2O+H+可知:所得溶液的pH=5,c(H+)=10-5mol/L, c(NH3H2O)= 10-5mol/L, 两溶液等体积混合,所以c(NH4+)=0.1 mol/L,根据水解平衡常数计算公式可得:Kh=KW/Kb= c(NH3H2O) ×c(H+)/ c(NH4+), KW=10-14,所以带入数值后得Kb≈1×10-5;正确答案:1×10-5。
NH3H2O+H+可知:所得溶液的pH=5,c(H+)=10-5mol/L, c(NH3H2O)= 10-5mol/L, 两溶液等体积混合,所以c(NH4+)=0.1 mol/L,根据水解平衡常数计算公式可得:Kh=KW/Kb= c(NH3H2O) ×c(H+)/ c(NH4+), KW=10-14,所以带入数值后得Kb≈1×10-5;正确答案:1×10-5。
(3)先把铵明矾水溶液进行蒸发浓缩 ,再降温结晶,过滤、洗涤,得到该物质的晶体,实验操作依次为蒸发浓缩 、冷却结晶; 正确答案:蒸发浓缩 、冷却结晶。
(4)有反应III可知,氢氧化铝溶于硫酸溶液生成硫酸铝,所以试剂Y为硫酸溶液,通过流程看出,溶液中的氢离子得电子变为氢气,那么只有硫酸根离子失电子变为S2O82-,则阳极电极反应式为2SO42-—2e-= S2O82-;正确答案:2SO42-—2e-= S2O82-。
(5)根据流程图看出,(NH4)2S2O8与水反应生成NH4HSO4,再根据原子守恒规律,得另外一种物质为H2O2,反应Ⅵ的化学方程式为(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2 ;正确答案:(NH4)2S2O8+2H2O = 2NH4HSO4+H 2O2。
(6)根据氧化还原反应规律:Mn2+被氧化生成MnO2,S2O82-被还原为SO42-,根据电子守恒、电荷守恒、原子守恒写出离子方程式为S2O82- + 2H2O + Mn 2+=4H+ + 2SO42- + MnO2↓;正确答案:S2O82- + 2H2O + Mn 2+=4H+ + 2SO42- + MnO2↓。过氧化氢也有较强氧化性,但在实际生产中不用Z氧化Mn2+,原因是锰的化合物可催化H2O2的分解,使消耗的H2O2增多;正确答案:锰的化合物可催化H2O2的分解,使消耗的H2O2增多。

 阅读快车系列答案
阅读快车系列答案【题目】某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
(1)根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是____________________。
(2)乙同学认为实验中可能生成Fe3+,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+,理由是 ____________________。
(3)乙同学继续探究红色褪去的原因,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mLFe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是____________________;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因____________________。
(4)丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红
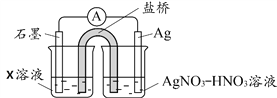
① 其中X溶液是____________________;
② 由实验得出Ag+和Fe2+反应的离子方程式是____________________;
③ 丙同学的实验设计及结论是否合理,请说明理由____________________。
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如图1: 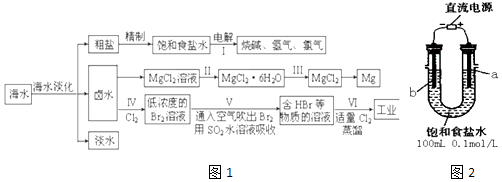
(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是(填铁、石墨),其电极反应式为 .
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为(忽略反应前后溶液体积的变化). (二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+ . 表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+ , 最适宜选用的物质是(填序号,下同),加入调节溶液的pH,充分反应后过滤,可得MgCl2溶液. a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2H2O获得MgCl2的操作是: .


