��Ŀ����
����Ŀ�������ܡ�ͭ����Ҫ�Ĺ���Ԫ��,�仯������й㷺����;��
(1)��λ��Ԫ�����ڱ��е�____��,��̬Cu�ĺ�������Ų�ʽ��_________��Ԫ������ͭ�ĵڶ������ֱܷ�Ϊ:ICu=1958kJ/mol��IFe=1561kJ/mol��ICu>IFe��ԭ����______________��
(2)�л����������������غ���(��),��ѧʽΪ:[Fe(H2NCONH2)6](NO3)3.
�����ط�����Cԭ�ӵ��ӻ���ʽ��_______�������ǽ���Ԫ�صĵ縺���ɴ�С��˳����_____��
��[Fe(H2NCONH2)6](NO3)3�С�H2NCONH2����Fe(��)֮�����������_______�����ݼ۲���ӶԻ��������Ʋ�NO3-�Ŀռ乹��Ϊ_________��
(3)Fe3+����SCN-���飬���Ӧ���������֣��ֱ�Ϊ������(H-S-C��N)����������(H-N=C=S),���������зе�ϸߵ���________________��ԭ����________________��
(4)FeCl3����������ˮ���Ҵ����þƾ��Ƽ��ȼ����������ɴ˿�֪FeCl3�ľ�������Ϊ_____��S��Fe�γɵ�ij������侧����ͼһ��ʾ��������ʵĻ�ѧʽΪ_______��

(5)Cu����Ķѻ���ʽ��ͼ����ʾ��������Cuԭ�ӵ���λ��Ϊ_______����Cuԭ�Ӱ뾶Ϊa,����ռ�������Ϊ_______(�ú�a��ʽ�ӱ��������)��
���𰸡� ��B 1s22s22p63s23p63d104s1 ��ͭʧȥ1�����Ӻ�Ϊ3d10,���Ϊȫ����,��Խ��ȶ�,��ʧȥ���ӽ��ѣ�����ʧȥ1�����Ӻ�Ϊ3d64s1,��ʧȥ������Խ����� sp2 O��N��C��H ��λ�� ƽ�������� ��������(H-N=C=S)�� ������������γɷ��Ӽ���� ���Ӿ��� FeS 12 
����������1���ܵ�ԭ������Ϊ27����Ԫ�������ڱ���λ�ڵ������ڵ�VIII��, Cu��ԭ������Ϊ29�� Cuԭ�ӵĻ�̬��������Ų�ʽΪ1s22s22p63s23p63d104s1�� ICu��IFe��ԭ����ͭʧȥ1�����Ӻ�Ϊ3d10�����Ϊȫ��������Խ��ȶ�����ʧȥ���ӽ��ѣ�����ʧȥ1�����Ӻ�Ϊ3d64s1����ʧȥ������Խ��ף���ȷ�𰸣�����1s22s22p63s23p63d104s1��ͭʧȥ1�����Ӻ�Ϊ3d10�����Ϊȫ��������Խ��ȶ�����ʧȥ���ӽ��ѣ�����ʧȥ1�����Ӻ�Ϊ3d64s1,��ʧȥ������Խ����ס�
��2�������ط�����Cԭ���γ�3���Ҽ���һ���м����ӻ���ʽ��sp2�������ǽ���Ԫ��Ϊ̼�������⡢����ͬһ���ڣ������ң�ԭ�Ӱ뾶��С��Ԫ�ص縺�������������ַǽ���Ԫ�صĵ縺���ɴ�С��˳����O��N��C��H ����ȷ�𰸣�O��N��C��H��
��Fe(��)�ṩ�չ��������H2NCONH2�е�����Nԭ���ṩ�µ��Ӷԣ�[Fe(H2NCONH2)6](NO3)3�С�H2NCONH2����Fe(��)֮�������������λ�������ݼ۲���ӶԻ������ۣ�NO3-����ԭ��N�ļ۲���Ӷ�Ϊ3+(5+1-2��3)/2=3���ӻ���ʽ��sp2���Ʋ�NO3���Ŀռ乹��Ϊƽ�������Σ���ȷ�𰸣���λ�� ��ƽ�������Ρ�
��3�������ᣨH-S-C��N�����������ᣨH-N=C=S���е�ϸߵ����������ᣨH-N=C=S�����÷�����Nԭ�ӵ縺�Խϴ��Ҵ���N�DH�����߱�����γɵ����������γɷ��Ӽ��������ȷ�𰸣���������(H-N=C=S)�� ������������γɷ��Ӽ������
��4��FeCl3����������ˮ���Ҵ����þƾ��Ƽ��ȼ���������˵��FeCl3�е�ͣ����Ӽ���С�����з��Ӿ�����ص�Ϊ���Ӿ��塣����ͼһ������Fe�ĸ���Ϊ4��Sԭ�ӵĸ���Ϊ8��1/8+6��1/2=4���ʸ����ʵĻ�ѧʽΪFeS����ȷ�𰸣����Ӿ��壻FeS��
��5����ͭ������һ�����ĵ�ԭ��Ϊ�۲�㣬��ƽ�����������ƽ���ϸ����ĸ�ԭ��������ԭ������Ҿ�����ȣ���12����������Cuԭ�ӵ���λ��Ϊ12��4��ͭԭ�ӵ����4��4��a3,�����ı߳�Ϊ4a����2/2,�ʿռ�������Ϊ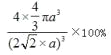 ����ȷ�𰸣�12��
����ȷ�𰸣�12��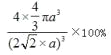 ��
��