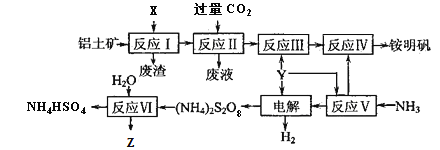
ћвƒњƒЏ»Ё
°Њћвƒњ°њƒ≥—–Њњ–°„йЌђ—ІЌ®єэѕ¬Ѕ–Ѕч≥ћ÷∆»°≤ї»№”ЏЋЃЇЌѕ°ЅтЋбµƒї∆ЉЎпІћъЈѓ1KNH4Fex£®OH£©y£®SO4£©z]£ђ≤ҐЌ®єэ µ—й≤вґ®—щ∆Ј÷–ї∆ЉЎпІћъЈѓµƒ”–єЎ„й≥…£Ѓ 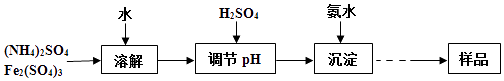
µ—й≤вґ®£Ї
Ґў≥∆»°“їґ®÷ Ѕњµƒ—щ∆ЈЉ”»лѕ°—ќЋб÷–≥дЈ÷»№љв£ђљЂЋщµ√»№“Ї„™“∆÷Ѕ»ЁЅњ∆њ≤Ґ≈д÷∆≥…l00mL»№“ЇA£ї
ҐЏЅњ»°25.00mL»№“ЇA£ђЉ”»л—ќЋбЋбїѓµƒBaCl2»№“Ї÷Ѕ≥ЅµнЌк»Ђ£ђєэ¬Ћ°Ґѕіµ”°ҐЄ…‘п÷ЅЇг÷Ў£ђµ√µљ∞„…Ђєћће4.66g£ї
ҐџЅњ»°25.00mL»№“ЇA£ђЉ”»л„гЅњKI£ђ”√1.000molL©Б1Na2S2O3»№“Їљш––µќґ®£®“—÷™Јі”¶ќ™I2+2Na2S2O3®T2NaI+Na2S4O6£©£ђѕыЇƒ30.00mL Na2S2O3»№“Ї÷Ѕ÷’µг£Ѓ
£®1£©‘Џ1KNH4Fex£®OH£©y£®SO4£©z]÷–x°Ґy°Ґzµƒіъ эєЎѕµ љќ™ £Ѓ
£®2£©єэ¬ЋЋщ–и“™µƒ÷ч“™≤£ЅІ“«∆ч”–°Ґ°Ґ £Ѓ
£®3£©–і≥ц µ—й≤вґ®Ґџ÷–Љ”»л„гЅњKIЈі”¶µƒјл„”Јљ≥ћ љ £Ѓ
£®4£©ЄщЊЁ“‘…ѕ µ—й эЊЁЉ∆Ћг—щ∆Ј÷–µƒn£®SO42©Б£©£Їn£®Fe3+£©£Ѓ£®–і≥цЉ∆Ћгєэ≥ћ£©
°Њір∞Є°њ
£®1£©3x+2=2y+z
£®2£©…’±≠£ї¬©ґЈ£ї≤£ЅІ∞ф
£®3£©2Fe3++2I©Б=I2+2Fe2+
£®4£©n£®SO42©Б£©=n£®BaSO4£©= ![]() =0.02mol
=0.02mol
°Њљвќц°њљв£Ї£®1£©‘Џ[KNH4Fex£®SO4£©y£®OH£©z]÷–£ђK‘™ЋЎїѓЇѕЉџ+1Љџ£ђN‘™ЋЎїѓЇѕЉџ©Б3Љџ£ђH‘™ЋЎїѓЇѕЉџ+1Љџ£ђSO42©БїѓЇѕЉџіъ эЇЌќ™©Б2Љџ£ђOH©БїѓЇѕЉџіъ эЇЌќ™©Б1Љџ£ђ+1+£®©Б3£©+£®+1£©°Ѕ4++3x+£®©Б2y£©+£®©Б1°Ѕz£©=0£ђx°Ґy°Ґzµƒіъ эєЎѕµ љќ™£Ї3x+2=2y+z£ђ
є ір∞Єќ™£Ї3x+2=2y+z£ї£®2£©єэ¬ЋЋщ–и“™µƒ÷ч“™≤£ЅІ“«∆ч”–…’±≠°Ґ¬©ґЈ°Ґ≤£ЅІ∞ф£ђ
є ір∞Єќ™|£ї…’±≠°Ґ¬©ґЈ°Ґ≤£ЅІ∞ф£ї£®3£©Ѕњ»°25.00mL»№“ЇA£ђЉ”»л„гЅњKI£ђЈҐ…ъ—хїѓїє‘≠Јі”¶£ђћъјл„”“‘Їуµвјл„”ќ™µвµ•÷ £ђЈі”¶µƒјл„”Јљ≥ћ љќ™£Ї2Fe3++2I©Б=I2+2Fe2+£ђ
є ір∞Єќ™£Ї2Fe3++2I©Б=I2+2Fe2+£ї£®4£©25ml»№“Ї÷–ЅтЋбЄщјл„”ќп÷ µƒЅњЇЌЅтЋб±µќп÷ µƒЅњѕаЌђ£ђn£®SO42©Б£©=n£®BaSO4£©= ![]() =0.02mol£ђ
=0.02mol£ђ
2Fe3+°Ђ | I2°Ђ | 2Na2S2O3 |
2 | 1 | 2 |
n£®Fe3+£©=2n£®I2£©=n£®Na2S2O3£©=1.000mol/L°Ѕ0.03L=0.03mol£ђ
—щ∆Ј÷–µƒn£®SO42©Б£©£Їn£®Fe3+£©=0.02mol£Ї0.03mol=2£Ї3£ђ
є ір∞Єќ™£Їn£®SO42©Б£©=n£®BaSO4£©= ![]() =0.02mol£ђ
=0.02mol£ђ
2Fe3+°Ђ | I2°Ђ | 2Na2S2O3 |
2 | 1 | 2 |
n£®Fe3+£©=2n£®I2£©=n£®Na2S2O3£©=1.000mol/L°Ѕ0.03L=0.03mol£ђ
—щ∆Ј÷–µƒn£®SO42©Б£©£Їn£®Fe3+£©=0.02mol£Ї0.03mol=2£Ї3£Ѓ
£®1£©їѓЇѕќп÷–‘™ЋЎїѓЇѕЉџіъ эЇЌќ™0Љ∆Ћгµ√µљ£ї£®2£©љбЇѕєэ¬Ћ≤ў„ч—°„ч–и“™µƒ≤£ЅІ“«∆ч£ї£®3£©Ѕњ»°25.00mL»№“ЇA£ђЉ”»л„гЅњKI£ђЈҐ…ъ—хїѓїє‘≠Јі”¶£ђћъјл„”“‘Їуµвјл„”ќ™µвµ•÷ £ї£®4£©Љ∆Ћг25mL»№“Ї÷–ћъјл„”ЇЌЅтЋбЄщјл„”ќп÷ µƒЅњ÷Ѓ±»£ђ∆д÷–ЅтЋбЄщјл„”ќп÷ µƒЅњЇЌЅтЋб±µќп÷ µƒЅњѕаЌђ£ђћъјл„”ќп÷ µƒЅњЉ∆Ћг“јЊЁµќґ®єэ≥ћ÷–ЈҐ…ъµƒїѓ—ІЈі”¶ґ®ЅњєЎѕµЉ∆Ћг£ђ2Fe3+°ЂI2°Ђ2Na2S2O3£ї

 √ы–£њќћ√ѕµЅ–ір∞Є
√ы–£њќћ√ѕµЅ–ір∞Є°Њћвƒњ°њЉьƒ№µƒіу–°њ…“‘ЇвЅњїѓ—ІЉьµƒ«њ»х£ђ“≤њ…”√”ЏєјЋгїѓ—ІЈі”¶µƒЈі”¶»»£®°чH£©£ђѕ¬√жЅ–ЊўЅЋ“ї–©їѓ—ІЉьµƒЉьƒ№ эЊЁ£ђє©Љ∆Ћг є”√
їѓ—ІЉь | Si©БO | Si©БCl | H©БH | H©БCl | Si©БSi | Si©БC |
Љьƒ№/kJ£Ѓmol©Б1 | 460 | 360 | 436 | 431 | 176 | 347 |
є§“µ…ѕµƒЄяіњєињ…Ќ®єэѕ¬Ѕ–Јі”¶÷∆»°£ЇSiCl4£®g£©+2H2£®g£©Si£®s£©+4HCl£®g£©£ђЄ√Јі”¶µƒƒжЈі”¶µƒ°чHќ™ ( )
A. ©Б236 kJmol©Б1 B. ©Б412 kJmol©Б1 C. +236 kJmol©Б1 D. +412 kJmol©Б1