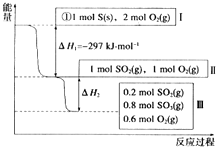
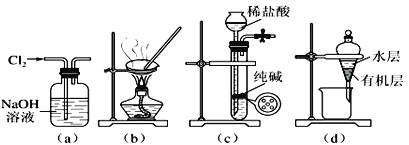
��Ŀ����
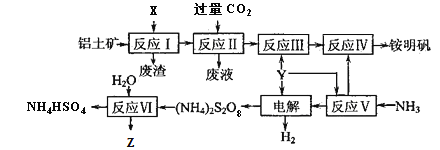
����Ŀ����ˮ���̲��ŷḻ����Դ����ˮ�ۺ����õ�����ͼ��ͼ1�� 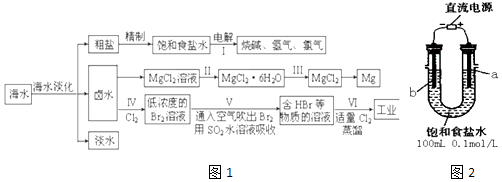
��һ��ij��ѧ�о�С����ͼװ��2ģ�ⲽ��I���ʳ��ˮ ��������ʯī���缫����
��1��a�缫��������������ʯī������缫��ӦʽΪ ��
��2������������11.2mL����ʱ����״����������Һ��pHΪ�����Է�Ӧǰ����Һ����ı仯���� ������±ˮ���̺��ŷḻ��þ��Դ����MgCl2�ֲ�Ʒ���ᴿ��þ��ұ�����̻ش��������⣺��֪MgCl2�ֲ�Ʒ����Һ�к���Fe2+��Fe3+��Al3+ �� ���������������������pH��
���� | Fe��OH��3 | Fe��OH��2 | Al��OH��3 | Mg��OH��2 |
��ʼ����pH | 2.7 | 8.1 | 3.8 | 9.5 |
��ȫ����pH | 3.7 | 9.6 | 4.8 | 11.0 |
��3����MgCl2�ֲ�Ʒ����Һ�е�Fe2+ת��ΪFe3+ �� ������ѡ�õ�������������ţ���ͬ��������������Һ��pH����ַ�Ӧ����ˣ��ɵ�MgCl2��Һ�� a��KMnO4 b��H2O2 c��MgO d��NaOH
��4���������MgCl2H2O���MgCl2�IJ����ǣ� ��
���𰸡�
��1��ʯī��2Cl����2e��=Cl2��
��2��12
��3��b�� c
��4����MgCl2?6H2O�ڸ����HCl�����м���
���������⣺��ˮ�����õ����Ρ�±ˮ���͵�ˮ�����ξ����Ƶõ�����ʳ��ˮ�����ʳ��ˮ�õ��������������������ƣ�±ˮ��������Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬�Ȼ���������ʧȥ�ᾧˮ�õ������Ȼ�þ����������Ȼ�þ���ɽ���þ��±ˮ��ͨ���������������������嵥�ʣ�ͨ���ȿ��������嵥��yoga��������ˮ��Һ���գ��õ�HBr����Һ����ͨ����������HBr�����嵥�ʣ��������ã�
��һ����1��װ��ͼ����ֱ����Դ�������ӵĵ缫aΪ��������Һ��������ʧ���ӷ���������Ӧ�����������缫��ӦΪ��2Cl����2e��=Cl2����
���Դ��ǣ�ʯī��2Cl����2e��=Cl2������2����������2H++2e��=H2����22.4mLΪ0.5��10��3mol������������0.001molOH������c��OH����= ![]() =0.01mol/L����ҺpH=12�����Դ��ǣ�12��
=0.01mol/L����ҺpH=12�����Դ��ǣ�12��
��������3����MgCl2�ֲ�Ʒ����Һ�е�Fe2+ת��ΪFe3+����ѡ�õ������ǹ������⡢������������������Ϊ�����ӣ�������ҺPH��ȥ��������Լ��������µ�����Ӧѡ������þ������̼��þ��
���Դ��ǣ�b��c����4�����ֱ���ڿ����м���MgCl26H2O��Mg2+��ˮ�������Mg��OH��Cl��HCl��ͨ��HCl����������ˮ�⣬Ӧ���Ȼ���������ʧˮ����Ȼ�þ���壻
���Դ��ǣ���MgCl26H2O�ڸ����HCl�����м��ȣ�

 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�