题目内容
3.写出下列物质在水溶液里的电离方程式:①硝酸钡Ba(NO3)2=Ba2++2NO3-;
②次氯酸钾KClO=K++ClO-.
分析 ①硝酸钡为强电解质,完全电离生成钡离子和硝酸根离子;
②次氯酸为强电解质,完全电离生成次氯酸根离子和钾离子.
解答 解:①硝酸钡为强电解质,完全电离生成钡离子和硝酸根离子,电离方程式:Ba(NO3)2=Ba2++2NO3-;
故答案为:Ba(NO3)2=Ba2++2NO3-;
②次氯酸为强电解质,完全电离生成次氯酸根离子和钾离子电离方程式;KClO=K++ClO-;
故答案为:KClO=K++ClO-.
点评 本题考查了电解质电离方程式的书写,解题关键在于明确电解质的强弱及电离方式,注意强电解质完全电离用等号,弱电解质部分电离用可逆号,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.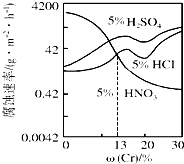 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 酸对Fe-Cr合金的腐蚀与阴离子浓度无关 |
8.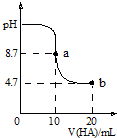 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | pH=7时,c(Na+)=0.05 mol•L-1 | |
| C. | a、b两点溶液中水电离出c(H+)浓度的比值为104 | |
| D. | b点所示溶液中c(A-)<c(HA) |
15.下列做法会对人体健康造成较大危害的是( )
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 硅胶常用作食品、药品干燥剂 | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
13.有一种银锌电池,其电极分别为Ag2O和ZnO,电解质溶液为KOH,电极反应式分别为:
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,根据上述电极反应式,下列说法正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | 使用过程中,电子由Ag2O极经外路流向Zn极 | |
| C. | 使用过程中,电极负极区溶液的pH减小 | |
| D. | Zn电极发生氧化反应,Ag2O电极发生还原反应 |
 ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.

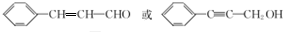 .
. (填结构简式).
(填结构简式).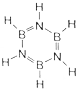 氮元素是一种常见元素,能形成多种化合物.
氮元素是一种常见元素,能形成多种化合物.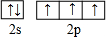 ,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.
,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.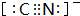 .
.