题目内容
13.A、B、C、D、E六种元素都在元素周期表的前四周期,原子序数依次增大.A原子L层的s、p电子数相等;B原子2p能级有两对成对电子;C与A同主族;D的原子序数是A的原子序数与B的原子序数之和;E原子的M层和N层电子分别比F原子的M层和N层电子少4个、5个.试根据以上信息,回答下列问题:(1 )A的基态原子电子排布图为
 ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.(2)A、C两元素可组成最简式为CA的化合物,该化合物的晶体类型属于原子晶体,其中A、C原子的杂化轨道类型为sp3杂化,键角是109°28′.
(3)B和F的氢化物中,沸点较髙的是HF(填氢化物的化学式);C和D最高价氧化物对应的水化物酸性较强的是H3PO4(填最高价氧化物对应的水化物的化学式).
(4)D与F结合形成DF3分子,该分子的空间构型是三角锥形.
(5)已知单质E的晶胞为体心立方堆积.则:
①该晶胞中含有E原子的数目为2个.
②写出计算E的原子半径的表达式r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{p{N}_{A}}}$(以cm表示,设E晶体的密度为pg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示)
分析 A原子L层的s、p电子数相等,原子核外电子排布式为1s22s22p2,则A为C元素;B原子2p能级有两对成对电子,原子核外电子排布式为1s22s22p5,则B为F元素;D的原子序数是A的原子序数与B的原子序数之和,D的原子序数为6+9=15,故D为P元素;C与A同主族,且C的原子序数小于磷,故C为Si;E原子的M层和N层电子分别比F原子的M层和N层电子少4个、5个,可知E原子外围电子排布为3d64s2、F原子外围电子排布为4s24p5,则E为Fe、F为Br.
解答 解:A原子L层的s、p电子数相等,原子核外电子排布式为1s22s22p2,则A为C元素;B原子2p能级有两对成对电子,原子核外电子排布式为1s22s22p5,则B为F元素;D的原子序数是A的原子序数与B的原子序数之和,D的原子序数为6+9=15,故D为P元素;C与A同主族,且C的原子序数小于磷,故C为Si;E原子的M层和N层电子分别比F原子的M层和N层电子少4个、5个,可知E原子外围电子排布为3d64s2、F原子外围电子排布为4s24p5,则E为Fe、F为Br.
(1 )A原子核外电子排布式为1s22s22p2,基态原子电子排布图为 ,D为P元素,原子的价层电子排布式为3s23p3,
,D为P元素,原子的价层电子排布式为3s23p3,
故答案为: ;3s23p3;
;3s23p3;
(2)A、C两元素可组成最简式为SiC的化合物,该化合物的晶体类型属于原子晶体,晶体中Si、C原子均形成4个Si-C,Si原子与周围的4个C原子形成正四面体结构,Si、C原子的杂化轨道类型为sp3杂化,键角是109°28′,
故答案为:原子;sp3杂化;109°28′;
(3)B和F的氢化物分别为HF、HBr,HF分子之间存在氢键,沸点高于HBr的;C和D最高价氧化物对应的水化物分别为硅酸、磷酸,P的非金属性比Si的强,则H3PO4的酸性更强,
故答案为:HF;H3PO4;
(4)D与F结合形成PBr3分子,P原子形成3个P-Br键,含有1对孤对电子,该分子的空间构型是三角锥形,
故答案为:三角锥形;
(5)已知单质E的晶胞为体心立方堆积.则:
①该晶胞中含有E原子的数目为1+8×$\frac{1}{8}$=2,故答案为:2;
②晶胞质量为2×$\frac{M}{{N}_{A}}$g,设算E的原子半径为r cm,晶胞体对角线长度为4r cm,棱长为$\frac{4r}{\sqrt{3}}$ cm,晶体的密度为pg/cm3,则2×$\frac{M}{{N}_{A}}$g=pg/cm3×($\frac{4r}{\sqrt{3}}$ cm)3,解得r=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{p{N}_{A}}}$,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{p{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞计算等,(5)中计算为易错点、难点,关键是明确原子半径与晶胞棱长关系,需要学生具备一定的数学计算能力.

 口算能手系列答案
口算能手系列答案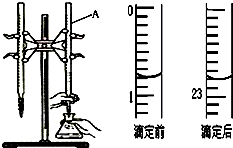 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如下表所示. 根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100 mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(5)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏高
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
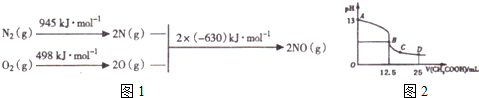
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.
| A. | 在医疗上碳酸钠可用于治疗胃酸过多 | |
| B. | 家用铁锅用水清洗后置于干燥处,能减缓电化学腐蚀 | |
| C. | 清洁能源所用光电池的生产材料主要是高纯度的二氧化硅 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
| A. | 1 | B. | l-a | C. | 2-lga | D. | 3-lga |
| A. | 分子式为C5H12的化合物,其一氯代物种类(不考虑立体异构)不可能是2种 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| D. | 石油裂化、油脂皂化和煤的干馏都是化学变化,而石油的分馏和蛋白质的盐析都是物理变化 |
| A. | 还原Fe粉 | B. | FeO | C. | Fe3O4 | D. | Fe2O3 |