题目内容
11.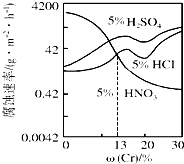 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 酸对Fe-Cr合金的腐蚀与阴离子浓度无关 |
分析 根据图中的纵横坐标可知,横坐标为Cr含量,纵坐标为金属被腐蚀的反应速率,由图中的曲线变化,硝酸对合金的腐蚀速率随Cr含量增加而变小,硫酸和盐酸对金属的腐蚀速率随Cr含量增加而变大,但随着Cr含量增加变化趋势变慢,则腐蚀性减弱.
解答 解:A.由图可知,铬的含量大于13%时,稀硝酸对合金的腐蚀速率比盐酸、硫酸弱,故A错误;
B.由图象可知,随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱,故B正确;
C.不能解释盐酸、硝酸氢离子浓度相等,但硝酸腐蚀速度慢,故C错误;
D.盐酸、硝酸的阴离子不同,可说明酸对Fe-Cr合金的腐蚀与阴离子浓度有关,故D错误.
故选B.
点评 本题以图形来考查学生对金属腐蚀的认识,明确图形中的曲线变化趋势及曲线的交点的含有是解答的关键,并能利用金属与酸的反应来分析解答金属的腐蚀.

练习册系列答案
相关题目
1.近年来我国汽车拥有量呈较快增墙长趋势,NOx、CO是汽车尾气中的主要污染物,
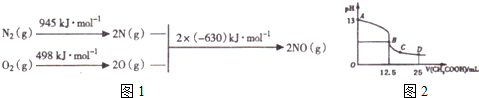
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
请回答下列问题:
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.

(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.
2.下列物质的颜色不是黑色的是( )
| A. | 还原Fe粉 | B. | FeO | C. | Fe3O4 | D. | Fe2O3 |
19.CH3CH2Br与NH3反应生成(CH3CH2)2NH和HBr,下列说法错误的是( )
| A. | CH3CH2Br难溶于水 | |
| B. | 该反应属于取代反应 | |
| C. | CH3CH2Br与HBr均属于电解质 | |
| D. | 若原料完全反应生成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 |
6.主链上有5个碳原子,且含有2个甲基、1个乙基两个支链的烷烃有( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
16.有关过氧化钠和饱和氢氧化钠溶液反应的现象及所得溶液的判断不正确的是( )
| A. | 有气泡产生,该气体能使带火星的火柴梗复燃 | |
| B. | 反应后溶液中有晶体析出 | |
| C. | 反应前后溶液中钠离子的浓度不变 | |
| D. | 反应前后溶液中钠离子的质量不变 |
20.能在溶液中大量共存的一组离子是( )
| A. | Cu2+、SO42-、OH-、K+ | B. | Fe3+、SCN-、Cl-、H+ | ||
| C. | K+、CO32-、Cl-、H+ | D. | H+、Na+、Cl-、SO42- |
1.在1L密闭容器内,一定条件下发生A+3B?2C反应,在10s内,反应物A的浓度由2mol降到1.2mol,则C的反应速率为( )
| A. | 1.6 mol/(L•s) | B. | 0.08 mol/(L•s) | C. | 0.16 mol/(L•s) | D. | 0.8 mol/(L•s) |