题目内容
18.与9g水所含分子数相同的氧气是16g;与18g水所含原子总数相同的CO2的质量是44g;相同条件下,在5.6g氮气中添加13.2gCO2,所组成的混合气体的体积与16g氧气所占的体积相等.分析 根据n=$\frac{m}{M}$计算水的物质的量,含有分子数目相等,则物质的量相等,再根据m=nM计算氧气的质量;
结合化学式计算18g水中含有原子物质的量,再计算二氧化碳的物质的量,根据M=nM计算二氧化碳的质量;
混合气体与16g氧气只有的体积相等,则与氧气物质的量相等,根据n=$\frac{m}{M}$计算氧气、氮气的物质的量,进而计算二氧化碳的物质的量,再根据m=nM计算二氧化碳的质量.
解答 解:9g水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,含有分子数目相等,则物质的量相等,故氧气的质量为0.5mol×32g/mol=16g;
18g水的物质的量为$\frac{18g}{18g/mol}$=1mol,含有原子物质的量为1mol×3=3mol,则二氧化碳的物质的量为$\frac{3mol}{3}$=1mol,则二氧化碳的质量为1mol×44g/mol=44g;
混合气体与16g氧气只有的体积相等,则混合气体与氧气物质的量相等,氧气物质的量为$\frac{16g}{32g/mol}$=0.5mol,5.6g氮气的物质的量为$\frac{5.6g}{28g/mol}$=0.2mol,则二氧化碳的物质的量为0.5mol-0.2mol=0.3mol,则二氧化碳的质量为0.3mol×44g/mol=13.2g,
故答案为:16;44;13.2.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算,有利于基础知识的巩固.

练习册系列答案
相关题目
8.生活与化学紧密联系,以下说法正确的是( )
| A. | 在医疗上碳酸钠可用于治疗胃酸过多 | |
| B. | 家用铁锅用水清洗后置于干燥处,能减缓电化学腐蚀 | |
| C. | 清洁能源所用光电池的生产材料主要是高纯度的二氧化硅 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
9.化学在生产和生活中有着重要的应用,下列叙述中正确的是( )
| A. | 漂白粉既可作纸张的漂白剂,又可用作游泳池的消毒剂 | |
| B. | 汽车尾气中含有氮的氧化物,是由汽油不完全燃烧造成的 | |
| C. | 氧化铝、氢氧化钠、碳酸氢钠都是常见的胃酸中和剂 | |
| D. | 工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的金属性比硅的强 |
6.主链上有5个碳原子,且含有2个甲基、1个乙基两个支链的烷烃有( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
13.下列各组物质分类中,按物质的分类后者从属于前者的是( )
| A. | 金属、非金属、稀有气体 | B. | 化合物、盐、酸式盐 | ||
| C. | 碱、碱性氧化物、碱式盐 | D. | 混合物、化合物、纯净物 |
10.为达到相应的实验目的,下列实验的设计或操作最合理的是( )
| A. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| B. | 在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶中,取出坩埚钳,盖上玻璃片,观察Mg条在集气瓶底部燃烧 | |
| C. | 为比较Cl与S元素非金属性强弱,相同条件下测定相同浓度NaCl溶液和Na2S溶液的pH值 | |
| D. | 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水 |
7.关于明矾的叙述正确的是( )
| A. | 明矾投入水中的电离方程式为:KAI(SO4)2•12H2O=K++Al3++2SO42-+12H20,说明明矾是一种混合物 | |
| B. | 净水时Al3+发生水解生成的是Al(OH)3沉淀 | |
| C. | 明矾净水的原理是杀菌消毒 | |
| D. | 硫酸铁可以代替明矾进行净水 |
8.下表是元素周期表的一部分,回答下列问题:
(1)写出②⑧⑩三种元素分别为N;Si;S.
(2)写出①、③两种元素形成的化合物有两种,化学式:CO,CO2.
(3)写出①元素最高价氧化物的电子式和结构式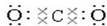 ,O=C=O.
,O=C=O.
(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出①、③两种元素形成的化合物有两种,化学式:CO,CO2.
(3)写出①元素最高价氧化物的电子式和结构式
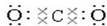 ,O=C=O.
,O=C=O.(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.