题目内容
20.下列有关阿伏伽德罗常数NA说法错误的是( )| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
分析 A.2H218O的摩尔质量为22g/mol,且含10个质子;
B.根据电解熔融的氯化钠时,电解2mol氯化钠,生成1mol氯气和2mol金属钠来分析;
C.钠离子的最外层含8个电子;
D.钠与氧气反应无论生成氧化钠还是过氧化钠,钠都失去1个电子生成+1价钠离子.
解答 解:A.2H218O的摩尔质量为22g/mol,且含10个质子,故22g该水的物质的量为1mol,含10NA个质子,故A正确;
B.58.5g氯化钠的物质的量为1mol,而电解熔融的氯化钠时,电解2mol氯化钠,生成1mol氯气和2mol金属钠,故当电解1mol氯化钠时生成0.5mol氯气即11.2L氯气,并生成1mol钠即23g钠,故B正确;
C.钠离子的最外层含8个电子,故1mol氯化钠中含1mol钠离子,则最外层含8mol电子即8NA个,故C错误;
D.反应后钠元素的化合价为+1价,故1mol钠失去1mol电子即NA个,故D正确;
故选:C.
点评 本题考查阿伏加德罗常数的相关计算,熟练掌握以物质的量为中心的转化关系,题目难度不大.

练习册系列答案
相关题目
20.各组微粒中,按半径由大到小、得电子能力由弱到强顺序排列的是( )
| A. | Rb、K、Na、Li | B. | Cl、S、P、N | ||
| C. | Na+、Mg2+、Al3+、H+ | D. | I-、Br-、Cl-、F- |
8.向含有1.2mol的FeCl2溶液中通入0.3molCl2,再加入含0.1mol X2O72- 的酸性溶液,使溶液中Fe2+全部恰好氧化,并使 X2O72- 还原为Xn+,则n值为( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
15.硅被誉为无机非金属材料的主角,下列物品用到硅单质的是( )
| A. | 光电池 | B. | 光导纤维 | C. | 石英钟表 | D. | 陶瓷餐具 |
5.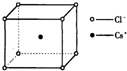 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )| A. | 2Ma3d | B. | M/(a3d) | C. | M/(2a3d) | D. | 2M/(a3d) |
12.某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的是( )
| A. | 有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 金属钠放入硫酸铜溶液中可以置换出金属铜 | |
| D. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色将表面 |
9. 有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )
有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )
 有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )
有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )| A. | PYT分子式为C16H6O4 | B. | 不能采用水溶液作为电解质溶液 | ||
| C. | 充电时,负极反应为Li-e-=Li+ | D. | 放电时,Li+向正极移动 |
10.下列溶液中的Cl-物质的量与100ml 1mol/L AlCl3溶液中Cl-物质的量相等的是( )
| A. | 150ml 1mol/LNaCl溶液 | B. | 100ml 3mol/L KClO3溶液 | ||
| C. | 75ml 2mol/L MgCl2溶液 | D. | 50ml 1mol/L FeCl3溶液 |