题目内容
20.各组微粒中,按半径由大到小、得电子能力由弱到强顺序排列的是( )| A. | Rb、K、Na、Li | B. | Cl、S、P、N | ||
| C. | Na+、Mg2+、Al3+、H+ | D. | I-、Br-、Cl-、F- |
分析 微粒半径的大小比较,先看电子层,电子层数越多半径越大,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;元素非金属性越强,越易得到电子,元素的金属性越强,对应离子的氧化性越弱,以此解答该题.
解答 解:A.都为碱金属元素,易失去电子,不能得到电子,故A错误;
B.Cl、S、P位于同一周期,原子半径逐渐增大,故B错误;
C.Na+、Mg2+、Al3+具有相同的核电荷数,核电荷数越大离子半径越小,H+离子半径最小,且得电子能力由弱到强,故C正确;
D.化合价都为最低价,只具有还原性,在反应中失去电子,不能得到电子,故D错误.
故选C.
点评 本题考查微粒半径比较、离子氧化性及还原性比较,为高频考点,侧重于学生的分析能力的考查,难度不大,掌握比较规律即可解答,有利于基础知识的巩固.

练习册系列答案
相关题目
11.分子式为C4H10O的醇与分子式为C6H12O2的羧酸形成的酯(不考虑立体异构)共有( )
| A. | 24 | B. | 32 | C. | 40 | D. | 48 |
8. Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
(Ⅰ) 某同学利用乙醛与新制氢氧化铜加热制的砖红色沉淀.
①乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O.
②砖红色沉淀加入稀硫酸,现象为溶液由无色变为蓝色,有红色不溶物.
③砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O.
(Ⅱ) Cu2O常用电解法制备,流程如下:
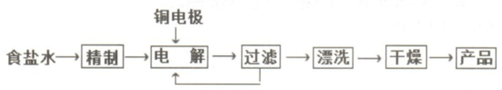
(1)精制食盐水需要除去其中的钙镁离子,依次加入的试剂为NaOH、Na2CO3、HCl.
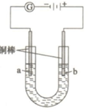
(2)实验室模拟电解装置如图,观察的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
则:ⅰ)电解池的阳极反应式为Cu+Cl--e-=CuCl↓.ⅱ)b极附近的白色沉淀开始变成黄色,颜色变化的离子方程式为CuCl+OH-=CuOH+Cl-.
此时溶液中c(OH-)/c(Cl-)=8.3×10-9.
(3)Cu2O在潮湿空气中容易被氧气氧化为CuO而变质,请设计实验方案检验其是否变质:加入足量浓盐酸,溶液变为绿色,则含有CuO.
 Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
①乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O.
②砖红色沉淀加入稀硫酸,现象为溶液由无色变为蓝色,有红色不溶物.
③砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O.
(Ⅱ) Cu2O常用电解法制备,流程如下:

(1)精制食盐水需要除去其中的钙镁离子,依次加入的试剂为NaOH、Na2CO3、HCl.
(2)实验室模拟电解装置如图,观察的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
则:ⅰ)电解池的阳极反应式为Cu+Cl--e-=CuCl↓.ⅱ)b极附近的白色沉淀开始变成黄色,颜色变化的离子方程式为CuCl+OH-=CuOH+Cl-.
此时溶液中c(OH-)/c(Cl-)=8.3×10-9.
(3)Cu2O在潮湿空气中容易被氧气氧化为CuO而变质,请设计实验方案检验其是否变质:加入足量浓盐酸,溶液变为绿色,则含有CuO.
15.实验室为了使用方便,通常将氯气溶解于水中形成氯水或将其降温加压形成液氯来使用.下列有关这两种液体的实验描述都正确的是( )
| A. | 两种液体都可以使干燥的布条褪色 | |
| B. | 两种液体都可以使干燥的蓝色石蕊试纸变红 | |
| C. | 用这两种液体都可给自来水消毒 | |
| D. | 分别向这两种液体中投人几颗金属锌粒均有气泡产生 |
3.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2
I2+2S2O32-═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2
I2+2S2O32-═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
20.下列有关阿伏伽德罗常数NA说法错误的是( )
| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
1. 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是HCN>H2CO3>CH3COOH>HNO2.
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)=v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸<m(H2)醋酸.
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为HCN+Na2CO3═NaCN+NaHCO3.
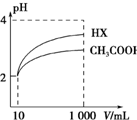
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示.稀释后,HX溶液中水电离的c(H+) 比醋酸溶液中水电离的c(H+)大;电离常数Ka(HX>Ka(CH3COOH)(填“>”、“=”或“<”),理由是稀释相同倍数,较强的酸pH变化较大,较强的酸电离常数较大,从图中看出HX的pH变化较大.
 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
①物质的量浓度相同的四种酸,其pH由大到小的顺序是HCN>H2CO3>CH3COOH>HNO2.
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)=v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸<m(H2)醋酸.
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为HCN+Na2CO3═NaCN+NaHCO3.
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示.稀释后,HX溶液中水电离的c(H+) 比醋酸溶液中水电离的c(H+)大;电离常数Ka(HX>Ka(CH3COOH)(填“>”、“=”或“<”),理由是稀释相同倍数,较强的酸pH变化较大,较强的酸电离常数较大,从图中看出HX的pH变化较大.