题目内容
10.下列溶液中的Cl-物质的量与100ml 1mol/L AlCl3溶液中Cl-物质的量相等的是( )| A. | 150ml 1mol/LNaCl溶液 | B. | 100ml 3mol/L KClO3溶液 | ||
| C. | 75ml 2mol/L MgCl2溶液 | D. | 50ml 1mol/L FeCl3溶液 |
分析 氯离子的物质的量浓度与溶液体积和溶质浓度无关,如:100ml 1mol/L AlCl3溶液中Cl-物质的量为:1mol/L×3×0.1L=0.3mol,据此进行解答.
解答 解:100mL 1mol/L AlCl3溶液中Cl-物质的量为:1mol/L×3×0.1L=0.3mol,
A.150ml 1mol/LNaCl溶液中氯离子的物质的量为:1mol/L×1×0.15L=0.15mol,故A错误;
B.100ml 3mol/L KClO3溶液中不存在氯离子,则氯离子的物质的量为0,故B错误;
C.75ml 2mol/L MgCl2溶液中氯离子物质的量为:2mol/L×2×0.075L=0.3mol,故C正确;
D.50mL 1mol/L FeCl3溶液中氯离子的物质的量为:1mol/L×3×0.05L=0.15mol,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与物质的量浓度的关系为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.下列有关阿伏伽德罗常数NA说法错误的是( )
| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
1. 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是HCN>H2CO3>CH3COOH>HNO2.
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)=v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸<m(H2)醋酸.
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为HCN+Na2CO3═NaCN+NaHCO3.
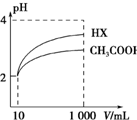
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示.稀释后,HX溶液中水电离的c(H+) 比醋酸溶液中水电离的c(H+)大;电离常数Ka(HX>Ka(CH3COOH)(填“>”、“=”或“<”),理由是稀释相同倍数,较强的酸pH变化较大,较强的酸电离常数较大,从图中看出HX的pH变化较大.
 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
①物质的量浓度相同的四种酸,其pH由大到小的顺序是HCN>H2CO3>CH3COOH>HNO2.
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)=v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸<m(H2)醋酸.
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为HCN+Na2CO3═NaCN+NaHCO3.
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示.稀释后,HX溶液中水电离的c(H+) 比醋酸溶液中水电离的c(H+)大;电离常数Ka(HX>Ka(CH3COOH)(填“>”、“=”或“<”),理由是稀释相同倍数,较强的酸pH变化较大,较强的酸电离常数较大,从图中看出HX的pH变化较大.
18.下列物质中,不能电离出酸根离子的是( )
| A. | Na2CO3 | B. | KMnO4 | C. | KOH | D. | H2SO4 |
5.化学与人类生活、社会可持续发展密切相关.下列有关叙述中不正确的是( )
| A. | 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| B. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 | |
| C. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 |
15.下列选项中,对于指定项目的数目前后相等的是( )
| A. | 电子数:17gOH-与1mol-OH | |
| B. | 双键数目:1mol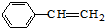 与4mol C2H4 与4mol C2H4 | |
| C. | 分子数:常温常压下16g氧气与4g氦气 | |
| D. | 阴离子总数:72gCaO2与62g Na2O |
19.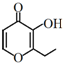 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
20.工业利用冶铜炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制Fe2O3的生产流程示意图如下:
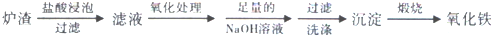
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
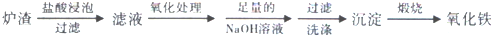
经“足量的NaOH溶液”处理后,铝元素的存在形态为( )
| A. | Al | B. | Al(OH)3 | C. | Al3+ | D. | [Al(OH)4]- |