题目内容
15.硅被誉为无机非金属材料的主角,下列物品用到硅单质的是( )| A. | 光电池 | B. | 光导纤维 | C. | 石英钟表 | D. | 陶瓷餐具 |
分析 晶体硅导电性介于导体与绝缘体之间,是良好的半导体材料,为无机非金属材料的主角,而二氧化硅具有熔点高、硬度大的特点,常用于制备耐高温材料和光导纤维,
据此解答.
解答 解:A.晶体硅导电性介于导体与绝缘体之间,是良好的半导体材料,是制作光电池注意原料,故A正确;
B.光导纤维的主要原料为二氧化硅,故B错误;
C.石英钟表的构成材料为二氧化硅,不是单质硅,故C错误;
D.陶瓷餐具的原料为二氧化硅,不是单质硅,故D错误;
故选:A.
点评 本题主要考查硅及其化合物的性质与应用,熟悉二氧化硅、硅的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
14.将下列各组溶液混合,不能发生复分解反应的是( )
| A. | NaOH溶液、稀盐酸 | B. | NaCl溶液、KNO3溶液 | ||
| C. | Na2CO3溶液、澄清石灰水 | D. | Na2CO3溶液、稀硝酸 |
15.实验室为了使用方便,通常将氯气溶解于水中形成氯水或将其降温加压形成液氯来使用.下列有关这两种液体的实验描述都正确的是( )
| A. | 两种液体都可以使干燥的布条褪色 | |
| B. | 两种液体都可以使干燥的蓝色石蕊试纸变红 | |
| C. | 用这两种液体都可给自来水消毒 | |
| D. | 分别向这两种液体中投人几颗金属锌粒均有气泡产生 |
3.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2
I2+2S2O32-═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2
I2+2S2O32-═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
20.下列有关阿伏伽德罗常数NA说法错误的是( )
| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
7.关于溶液的酸碱性说法正确的是( )
| A. | [H+]很小的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | [OH-]=[H+]的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
5.化学与人类生活、社会可持续发展密切相关.下列有关叙述中不正确的是( )
| A. | 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| B. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 | |
| C. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 |
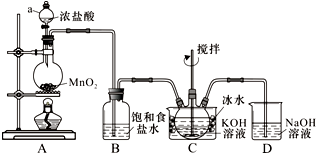 实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
实验室用图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.