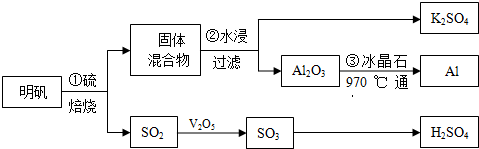
题目内容
5.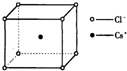 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,则氯化铯晶体的密度为d g•cm-3,阿伏加德罗常数的值可表示为( )| A. | 2Ma3d | B. | M/(a3d) | C. | M/(2a3d) | D. | 2M/(a3d) |
分析 该晶胞为体心立方密堆积,晶体中2个最近的Cs+离子核间距为a cm,则晶胞棱长为acm,图可以看出氯化铯晶体的晶胞中,含有一个铯原子和一个氯原子,用阿伏伽德罗常数表示出晶胞质量,再结合m=ρV计算.
解答 解:该晶胞为体心立方密堆积,晶体中2个最近的Cs+离子核间距为a cm,则晶胞棱长为acm,图可以看出氯化铯晶体的晶胞中,含有1个铯原子、氯原子数目为8×$\frac{1}{8}$=1,晶胞质量为$\frac{M}{{N}_{A}}$g,则$\frac{M}{{N}_{A}}$g=(a cm)3×d g•cm-3,解得NA=$\frac{M}{{d×a}^{3}}$,
故选:B.
点评 本题考查晶胞计算,关键是表示出晶胞质量与体积,理解均摊法进行晶胞有关计算.

练习册系列答案
相关题目
13.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.0g沉淀,对样品所含杂质的正确判断是( )
| A. | 肯定有KNO3和Na2CO3,没有Ba(NO3)2 | |
| B. | 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 | |
| C. | 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 | |
| D. | 以上判断都不正确 |
20.下列有关阿伏伽德罗常数NA说法错误的是( )
| A. | 22g2H218O中含有的质子数为10NA | |
| B. | 电解58.5g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠 | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为10NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
17.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | lmol•L?1的NaCl溶液中所含Na+为NA个 | |
| B. | 标准状况下,11.2 L SO3所含的分子数为0.5NA | |
| C. | 0.1 mol CH4所含的电子数为1NA | |
| D. | 2molNO和1mol O2混合,所得气体分子数为2NA |
15.下列选项中,对于指定项目的数目前后相等的是( )
| A. | 电子数:17gOH-与1mol-OH | |
| B. | 双键数目:1mol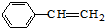 与4mol C2H4 与4mol C2H4 | |
| C. | 分子数:常温常压下16g氧气与4g氦气 | |
| D. | 阴离子总数:72gCaO2与62g Na2O |
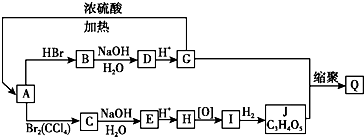
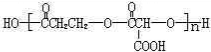 .
.