题目内容
5.以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌.Ⅰ、制取氯化锌主要工艺如图:
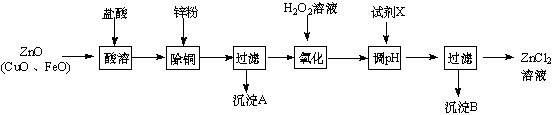
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
(2)流程图中,为了降低溶液的酸度,试剂X可以是abc (选填序号:a.ZnO;b.Zn(OH)2;c.Zn2(OH)2CO3;d.ZnSO4);pH应调整到3.2≤pH<5.2.
(3)氯化锌能催化乳酸(
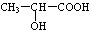 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq)},然后电解浸取液.
(4)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-.
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
分析 炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,滤液中含有锌离子和亚铁离子,加过氧化氢氧化,把亚铁离子氧化为铁离子,加ZnO(或氢氧化锌等)调节PH,铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液,
(1)加过氧化氢把亚铁离子氧化为铁离子;
(2)调节pH时要消耗氢离子,但是不能引入杂质;调节pH使铁离子转化为沉淀,而锌离子不沉淀,根据表中数据分析;
(3)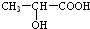 分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应;
分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应;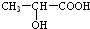 分子间发生缩聚反应生成聚乳酸和水;
分子间发生缩聚反应生成聚乳酸和水;
(4)石墨作电极电解时,阳极氢氧根离子失电子,阴极上[Zn(OH)4]2-得电子;
(5)ZnO能溶液强碱溶液,CuO和FeO不溶于碱溶液.
解答 解:炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,滤液中含有锌离子和亚铁离子,加过氧化氢氧化,把亚铁离子氧化为铁离子,加ZnO(或氢氧化锌等)调节PH,铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液,
(1)加过氧化氢亚铁离子氧化为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)调节pH时要消耗氢离子,但是不能引入杂质,ZnO、Zn(OH)2、Zn2(OH)2CO3均与氢离子反应生成锌离子,消耗氢离子的同时不引人杂质,ZnSO4不能与氢离子反应,所以不能调节pH;调节pH使铁离子转化为沉淀,而锌离子不沉淀,由表中数据可知pH≥3.2时,铁离子完全沉淀,而锌离子开始沉淀的pH为5.2,所以要调节pH为3.2≤pH<5.2;
故答案为:abc;3.2≤pH<5.2;
(3)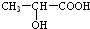 分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为
分子中含有-COOH和-OH,两分子的乳酸分子间发生酯化反应,反应产物为 ;
;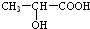 分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为:
分子间发生缩聚反应生成聚乳酸和水,聚乳酸的结构简式为: ;
;
故答案为: ;
; ;
;
(4)石墨作电极电解时,阳极氢氧根离子失电子,阳极反应为:4OH--4e-═2H2O+O2↑,阴极上[Zn(OH)4]2-得电子生成Zn,则阴极的电极方程式为:[Zn(OH)4]2-+2e-=Zn+4OH-;
故答案为:O2;[Zn(OH)4]2-+2e-=Zn+4OH-;
(5)ZnO能溶液强碱溶液,CuO和FeO不溶于碱溶液,酸溶液与ZnO、CuO、FeO均能反应,所以炼锌烟尘采用碱溶,而不采用酸溶后电解,
故答案为:氧化铜、氧化亚铁不溶于碱溶液中.
点评 本题考查了物质的制备工艺流程,侧重于流程的分析、物质的分离提纯、氧化还原反应的应用、酯化反应和缩聚反应、电解原理的应用等知识点的考查,题目难度中等,考查了学生对基础知识的综合应用能力.

| A. | c (Na+)=c (HB-)+2 c (B2-)+c (H2B) | B. | c(Na+)=0.01 mol/L≥c (B2-) | ||
| C. | c (H+)•c (OH-)=10-14 | D. | c (Na+)+c (H+)=c(HB-)+c (B2-)+c (OH-) |
| A. | 该饱和溶液的物质的量浓度为5.07mol•L-1 | |
| B. | 向该溶液中加入等体积的水之后溶液的质量分数小于13.25% | |
| C. | 25℃时,密度等于1.12g•cm-3的NaCl溶液是饱和溶液 | |
| D. | 将此溶液蒸发掉部分水,再恢复到20℃时,溶液密度一定大于1.12g•cm-3 |
| A. | 2,2,3,3-四甲基丁烷 | B. | 3,4-二甲基己烷 | ||
| C. | 2,2,3-三甲基戊烷 | D. | 3-甲基-3-乙基戊烷 |
(1)成分探究:小组成员发现硫酸亚铁补血剂外面糖衣是红色的,里面是淡蓝绿色的,甲同学对其组成进行如下探究:
| 实验探究 | 实验操作及现象 | 结论分析 |
| 探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化. ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加KSCN溶液溶液,变成血红色. | 证明淡蓝绿色粉末为FeSO4 |
| 探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象. | 证明:红色物质不是Fe2O3. |
补血剂(1片0.5克)$\stackrel{①溶解}{→}$浊液$→_{③}^{②脱色}$滤液$\stackrel{④氧化}{→}$配成1L待测液
①步骤③浊液脱色后进行A(填标号)操作才能得到溶液.

②甲同学认为步骤③滤液直接蒸发结晶不能得到硫酸亚铁晶体,理由是因为硫酸亚铁在加热过程中易被氧化,,你的方案是加入足量铁粉,小心蒸发至出现结晶膜时停止加热.
③已知步骤④中加入足量的H2O2溶液,作用是将Fe2+完全氧化成Fe3+,然后微热并用玻璃棒搅拌至无气泡产生,目的是除去过量的H2O2.
④写出步骤④中发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(3)测定硫酸亚铁补血剂待测液的浓度
【方法一】用紫外分光光度法:使用紫外分光光度计,将不同波长的光连续地照射到一定标准浓度滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液的硫酸亚铁标准溶液,得到与不同波长相对应的吸收强度,以硫酸亚铁标准溶液的浓度为横坐标,吸光度为纵坐标,绘出该物质的吸收光谱曲线如图.
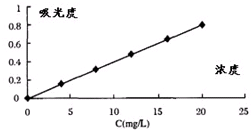
⑤取待测液10mL滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液,并稀释至60mL,用紫外分光光度法测得待测液的吸光度为0.4,则样品中铁元素的质量分数是12%.
【方法二】KMnO4标准溶液滴定法:称取4.0g的硫酸亚铁产品,溶于水,加入适量稀硫酸,用0.2mol•L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00mL.
⑥KMnO4溶液置于酸式滴定管中,终点的颜色变化:浅绿色变成浅黄色
⑦要达到好的治疗效果,服用补血剂时需注意口服铁剂应同时并服维生素C,理由是维生素C具有还原性,防止Fe2+被氧化.




