题目内容
15.已知金属钠投入水中能发生反应2Na+2H2O═2NaOH+H2↑.如将2.3g钠投入水中,充分反应.据此计算下列问题①求生成的NaOH的物质的量.
②求生成的H2的体积(标准状况).
③如反应后得到的溶液中Na+与水分子的个数比为1:100,则开始时所用的水的质量是多少克?
分析 n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,
①根据Na原子守恒计算生成的NaOH的物质的量;
②根据转移电子守恒计算生成的H2的体积(标准状况);
③如反应后得到的溶液中Na+与水分子的个数比为1:100,根据N=nNA知,则钠离子和溶液中水分子的物质的量之比为1:100,Na和水反应还消耗水,根据方程式知,消耗水的物质的量等于钠的物质的量,据此计算开始时所用的水的质量.
解答 解:n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,
①根据Na原子守恒得生成n(NaOH)=n(Na)=0.1mol,答:生成NaOH的物质的量是0.1mol;
②该反应中钠失去电子的物质的量等于生成氢气得到电子的物质的量,根据转移电子守恒得V(H2)=$\frac{0.1mol×1}{2}×22.4L/mol$=1.12L,
答:生成氢气的体积为1.12L;
③如反应后得到的溶液中Na+与水分子的个数比为1:100,根据N=nNA知,则钠离子和溶液中水分子的物质的量之比为1:100,所以溶液中还剩余n(H2O)=100n(Na+)=100n(Na)=100×0.1mol=10mol;
Na和水反应还消耗水,根据方程式知,消耗水的物质的量等于钠的物质的量,所以消耗n(H2O)=n(Na)=0.1mol,则开始时所用n(H2O)=(10+0.1)mol=10.1mol,其质量=10.1mol×18g/mol=181.8g,
答:开始时所用的水的质量是181.8g.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量的关系式是解本题关键,注意原子守恒、转移电子守恒的灵活运用,侧重考查学生分析计算能力,注意③中易漏掉参加反应的水的质量,题目难度不大.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案Ⅰ、制取氯化锌主要工艺如图:
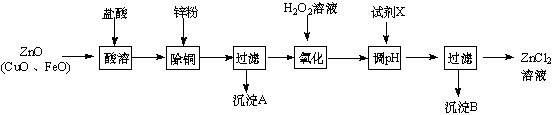
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
(2)流程图中,为了降低溶液的酸度,试剂X可以是abc (选填序号:a.ZnO;b.Zn(OH)2;c.Zn2(OH)2CO3;d.ZnSO4);pH应调整到3.2≤pH<5.2.
(3)氯化锌能催化乳酸(
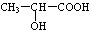 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)═Na2[Zn(OH)4](aq)},然后电解浸取液.
(4)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-.
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
(1)光谱证实单质Al与强碱溶液反应有[Al(OH)4]-生成,则[Al (OH)4]-中存在acd(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C,Si,H的电负性由大到小的顺序为C>H>Si.
(3)Fe和Mn两元素的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)晶体熔点:MgO>CaO(填“>”、“<”或“=”),原因是MgO与CaO都为离子晶体,Mg2+半径小于Ca2+,则MgO的晶格能大于CaO,所以MgO熔点高
(5)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| A. | 浓硫酸 | B. | CO2 | C. | 铁粉 | D. | 冰水混合物 |
| A. | 锥形瓶 | B. | 蒸馏烧瓶 | C. | 烧杯 | D. | 蒸发皿 |
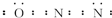 ,其分子空间构型是直线形.
,其分子空间构型是直线形.