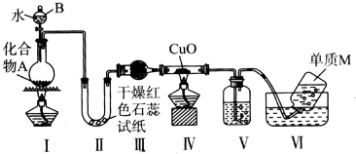
题目内容
7.海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列.从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法:蒸馏法;电渗析法.
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-.由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了如下装置简图:
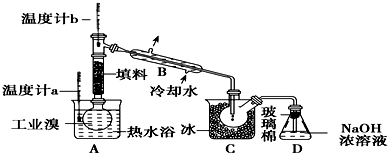
请你参与分析讨论:
①图中仪器B的名称:冷凝管.
②C中产生液体的颜色为深红棕色.为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是分液.
分析 通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2,
(1)除去海水中的盐分以获得淡水的工艺过程叫海水淡化,亦称海水脱盐.海水淡化的方法,基本上分为两大类:从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法;除去海水中的盐分,有电渗拆法、离子交换法和压渗法;
(2)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(3)SO2吸收溴,依据氧化还原反应生成物书写基本规律,Br元素在自然中-1价稳定.由于此反应有强酸HBr和H2SO4生成,易腐蚀设备,据此写出工业生产需要解决的问题;
(4)工业制溴中提纯溴的方法,主要是利用蒸馏方法,由于Br2具有强氧化性,易把橡胶塞和橡胶管氧化腐蚀,所以不用橡胶塞和橡胶管;由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;C中液体为冷凝下来的纯溴,则颜色为深棕红色,除去该产物中仍残留的少量Cl2,加入NaBr溶液,和氯气反应生成氯化钠和溴单质,达到除去氯气的目的,充分反应后,用蒸馏的方法得到.
解答 解:通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2,
(1)海水淡化的有蒸馏法、电渗析法、离子交换法等,故答案为:蒸馏法;电渗析法;
(2)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,
故答案为:富集溴元素;
(3)在水溶液里溴和二氧化硫反应离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,由此反应可知,生成物为强酸,所以除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;强酸对设备的严重腐蚀;
(4)①图中仪器B的名称是冷凝管,故答案为:冷凝管;
②溴C中液体产物为溴,颜色为深红棕色,为除去该产物中仍残留的少量C12,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是分液,故答案为:深红棕色;分液.
点评 本题考查了海水资源的综合利用,题目难度中等,注意从整体上把握溴的提纯过程,知道提纯过程中发生的反应及基本操作方法,再结合物质的性质分析解答.

| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 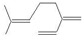 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
| A. | CH2CH2--乙烯的结构简式 | B. | C2H6--乙烷的结构简式 | ||
| C. |  -甲基的电子式 -甲基的电子式 | D. |  --苯的分子式 --苯的分子式 |
| A. | 醋酸与烧碱混合:H++OH-═H2O | |
| B. | 大理石中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 稀硫酸滴在铁片上:Fe+2H+═Fe2++H2↑ | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:Cu2++2OH-═Cu(OH)2↓ |
| 族 周 期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i | |
| 4 | j | k |
(2)k原子的电子层数为4,f原子最外层电子数为4.
(3)这11种元素中,单质的化学性质最稳定的是Ar.
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3(写化学式);写出它们两两反应的化学方程式:HClO4+KOH=KClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O.
(5)证明c、d原子失电子能力强弱的实验方法是Na与冷水反应生成氢气比Mg更剧烈;证明g、h原子得电子能力强弱的方法(用离子方程式表示)是H2S+Cl2=2H++S↓+2Cl-.
| A. | ${\;}_{3}^{6}$Li与${\;}_{3}^{7}$Li | B. | D2O与H2O | ||
| C. | ${\;}_{6}^{14}$C与${\;}_{7}^{14}$N | D. | 金刚石与石墨 |
| A. | ①④②③ | B. | ④③②① | C. | ②③④① | D. | ①④③② |
| 选项 | 叙述 | 评价 |
| A | 可用氢氧化钠醇溶液与硝酸酸化的硝酸银溶液鉴别烷烃与卤代烃 | 对.卤代烃都能与氢氧化钠醇溶液共热生成卤化钠.卤化钠与硝酸酸化的硝酸银溶液反应可生成卤化银沉淀 |
| B | 乙酸乙酯在H218O中水解,产物乙酸中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素.而乙醇則没有 |
| C | 不能用酸性高锰酸钾溶液除去甲烷中的乙烯气体 | 对.乙烯虽能与酸性高锰酸钾溶液反应,但会生成 CO2 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和乙醛溶液 | 对.乙醇、乙酸和乙醛与新制的Cu(OH)2悬浊液反应现象皆不同.可以一次性鉴别 |
| A. | A | B. | B | C. | C | D. | D |