题目内容
18.以下说法哪些是正确的( )| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
分析 氢键介于分子间作用力和化学键之间,是一种独特的分子间作用力,不是化学键,存在于非金属性极强的非金属元素的氢化物之间,影响物质的熔沸点等物理性质.
解答 解:A.氢键属于分子间作用力,不属于化学键,故A错误;
B.甲烷中C原子电负性不大,所以甲烷分子和水分子之间不能形成氢键,故B错误;
C.乙醇分子和水分子间存在氢键,故乙醇分子和水分子间除了范德华力,还存在氢键,故C正确;
D.氯化氢与碘化氢都属于分子晶体,分子结构相同,碘化氢相对分子质量较大,分子间作用力较强,沸点较高,与氢键无关,故D错误.
故选C.
点评 本题考查氢键的形成与性质,题目难度不大,注意氢键与分子间作用力、化学键的区别,易错点为氢键对物质性质的影响.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
8. 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | R与Q的电子数相差18 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | 最高价氧化物对应水化物的酸性:T>Q |
9.NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得.工艺流程如图:
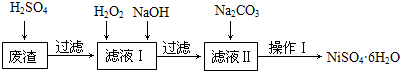
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如表所示.
注:NiCO3是一种不溶于水易溶于强酸的沉淀.
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有AC.
A.升高反应温度B.增大压强C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示);加入NaOH调节pH的范围是5.6≤pH<8.4,为了除去溶液中的Fe3+、Cr3+离子.
(3)滤液Ⅱ的主要成分是Na2SO4、NiSO4.
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成.
(5)操作Ⅰ的实验步骤依次为:
①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如表所示.
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有AC.
A.升高反应温度B.增大压强C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示);加入NaOH调节pH的范围是5.6≤pH<8.4,为了除去溶液中的Fe3+、Cr3+离子.
(3)滤液Ⅱ的主要成分是Na2SO4、NiSO4.
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成.
(5)操作Ⅰ的实验步骤依次为:
①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.
6.判断下列有关化学基本概念的依据正确的是( )
| A. | 氧化还原反应:元素化合价是否变化 | |
| B. | 共价化合物:是否含有共价键 | |
| C. | 强弱电解质:溶液的导电能力大小 | |
| D. | 氧化物:含氧化合物 |
13.常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
下列判断正确的是( )
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | c1=0.2 | |
| B. | 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| C. | a>9 | |
| D. | 在乙组混合液中由水电离出的c(OH-)=10-5mol•L-1 |
10.下列说法正确的是( )
| A. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| B. | 为增强氯水的漂白性,可以向其中加入碳酸钙 | |
| C. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| D. | 均含有NA个电子的H2O和CH4具有相同的体积 |
7.天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:
CH4+2O2→CO2+2H2O,C3H8+5O2→3CO2+4H2O
现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是( )
CH4+2O2→CO2+2H2O,C3H8+5O2→3CO2+4H2O
现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是( )
| A. | 增大空气进入量或减小石油气进入量 | |
| B. | 增大空气进入量,增大石油气进入量 | |
| C. | 减小空气进入量,减小石油气进入量 | |
| D. | 减小空气进入量或增大石油气进入量 |
8. 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
Ⅰ.实验原理:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计:
(1)【方案一】测量气体产物:在相同温度下,利用如图装置,测定不同浓度H2C2O4溶液与KMnO4反应产生相同体积CO2所需的时间(忽略CO2溶解性的影响).如图方框中应选择①②④⑤⑥(填编号)仪器组装量气装置,限选以下仪器:①广口瓶、②双孔塞、③水槽、④橡胶管、⑤导管、⑥量筒.
(2)【方案二】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:表中①、②处的数据分别是5.0、25.
Ⅲ.讨论与交流:
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.KMnO4溶液置于酸式滴定管(填“酸式”或“碱式”)中,判断到达滴定终点的现象是当滴入最后一滴KMnO4溶液时,溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.Ⅰ.实验原理:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计:
(1)【方案一】测量气体产物:在相同温度下,利用如图装置,测定不同浓度H2C2O4溶液与KMnO4反应产生相同体积CO2所需的时间(忽略CO2溶解性的影响).如图方框中应选择①②④⑤⑥(填编号)仪器组装量气装置,限选以下仪器:①广口瓶、②双孔塞、③水槽、④橡胶管、⑤导管、⑥量筒.
(2)【方案二】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:表中①、②处的数据分别是5.0、25.
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.KMnO4溶液置于酸式滴定管(填“酸式”或“碱式”)中,判断到达滴定终点的现象是当滴入最后一滴KMnO4溶液时,溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).



 .
.