题目内容
8. 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.Ⅰ.实验原理:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计:
(1)【方案一】测量气体产物:在相同温度下,利用如图装置,测定不同浓度H2C2O4溶液与KMnO4反应产生相同体积CO2所需的时间(忽略CO2溶解性的影响).如图方框中应选择①②④⑤⑥(填编号)仪器组装量气装置,限选以下仪器:①广口瓶、②双孔塞、③水槽、④橡胶管、⑤导管、⑥量筒.
(2)【方案二】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:表中①、②处的数据分别是5.0、25.
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.KMnO4溶液置于酸式滴定管(填“酸式”或“碱式”)中,判断到达滴定终点的现象是当滴入最后一滴KMnO4溶液时,溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
分析 Ⅱ.(1)用排水法测量气体的体积,进气口应是短进长出,如图所示: ;
;
(2)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间,实验时溶液的体积相同,H2C2O4的浓度不同;
Ⅲ.(3)高锰酸钾会腐蚀橡胶,不能用碱式滴定管;根据溶液由无色变为浅紫红色进行判断;若读取滴定管数据时,起始读数正确,终点俯视读数,导致所读体积偏小,即需要的高锰酸钾的体积偏小,则测定的浓度偏小.
解答 解:Ⅱ.(1)用排水法测量气体的体积,进气口应是短进长出,如图所示: ,所需仪器有①广口瓶、②双孔塞、④橡胶管、⑤导管、⑥量筒,
,所需仪器有①广口瓶、②双孔塞、④橡胶管、⑤导管、⑥量筒,
故答案为:①②④⑤⑥;
(2)在相同温度下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间,实验时溶液的体积相同,H2C2O4的浓度不同,则②应为25℃,由①③数据可知溶液总体积为15.0mL,则①为15.0mL-2.0mL-4.0mL-4.0mL=5.0mL,
故答案为:5.0;25;
Ⅲ.(3)高锰酸钾具有腐蚀性,应放在酸式滴定管中,达到滴定终点时,溶液由无色变为红色,若读取滴定管数据时,起始读数正确,终点俯视读数,导致所读体积偏小,即需要的高锰酸钾的体积偏小,则测定的浓度偏小,
故答案为:酸式;当滴入最后一滴KMnO4溶液时,溶液由无色变为浅紫红色,且半分钟内不褪色;偏低.
点评 本题考查化学反应速率的影响因素的探究,为高频考点,侧重于学生的分析能力和实验能力的考查,有利于培养学生的良好的科学素养,难度中等.

练习册系列答案
相关题目
18.以下说法哪些是正确的( )
| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
3.2005年6月5日我国环境日主题是“人人参与,创建绿色家园”.下列说法不正确的是( )
| A. | 回收废旧电池 | |
| B. | 加强控制燃放烟花爆竹法规 | |
| C. | 停止使用含铅汽油 | |
| D. | 将工厂烟囱加高,减少周围大气污染 |
13.某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
(1)比较三组数据,初步得出的结论是:当其他条件不变时,H2SO4(填化学式)的浓度增加,反应速率加快(填“加快”、“减慢”或“不变”);
(2)写出该反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,该反应中还原剂是Zn,从反应分类角度来看,该反应既属于氧化还原反应,又属于置换反应(填四大基本反应类型之一).
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 12g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
(2)写出该反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,该反应中还原剂是Zn,从反应分类角度来看,该反应既属于氧化还原反应,又属于置换反应(填四大基本反应类型之一).
20.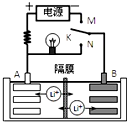 如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
LiMnO2+C6$?_{放电}^{充电}$Li1-xMnO2+LixC6(LixC6表示锂原子嵌入石墨形成的复合材料),下列有关说法正确的是( )
 如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:LiMnO2+C6$?_{放电}^{充电}$Li1-xMnO2+LixC6(LixC6表示锂原子嵌入石墨形成的复合材料),下列有关说法正确的是( )
| A. | K与N相接时,A极为负极,该电极反应式为:LixC6-xeˉ=C6+xLi+ | |
| B. | 该电池的比能量与用单质锂作电极的锂电池的比能量相同 | |
| C. | K与M相接时,A极发生氧化反应,LiMnO2-xeˉ=Li1-xMnO2+xLi+ | |
| D. | K与N相接时,Li+由A极区迁移到B极区 |
17.充分燃烧1mol气态烃R,得到标准状况下44.8LCO2和54gH2O,则R是( )
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C4H6 |
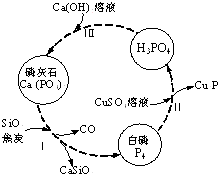 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.