题目内容
16.某同学用如图所示装置图制取并收集干燥的氯气.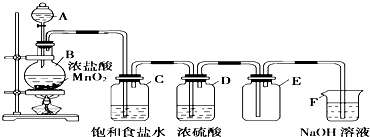
回答下列问题:
(1)写出圆底烧瓶中发生的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置C的作用是除去氯气中氯化氢,装置D的作用是干燥氯气.
(3)装置F的作用是吸收过量氯气,防止空气污染.
(4)装置B中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl的物质的量为0.2mol.
(5)F处发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
分析 实验室用二氧化锰与浓盐酸反应制取氯气,因为浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气等杂质,依据氯气在饱和食盐水中溶解度较小、氯化氢易溶于水的性质选择用盛有饱和食盐水的洗气瓶除去氯气中的氯化氢,然后通过盛有浓硫酸的洗气瓶干燥氯气,氯气密度大于空气密度,用向上排气法收集,氯气有毒需要进行尾气处理,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)圆底烧瓶中二氧化锰与浓盐酸反应生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢、水蒸气等杂质,依据氯气在饱和食盐水中溶解度较小、氯化氢易溶于水的性质选择用盛有饱和食盐水的洗气瓶除去氯气中的氯化氢,然后通过盛有浓硫酸的洗气瓶干燥氯气;
故答案为:除去氯气中的氯化氢,干燥氯气;
(3)氯气有毒需要进行尾气处理,能够与氢氧化钠反应,被氢氧化钠吸收;
故答案为:吸收过量氯气,防止空气污染;
(4)装置A中,如果反应产生氯气的体积为2.24L(标准状况),其物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,
故答案为:0.2mol;
(5)氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
点评 本题考查氯气的实验室制备,为高频考点,明确氯气制备原理和氯气的性质是解题关键,题目难度不大.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 大理石和稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氧化铝和氢氧化钠溶液反应:Al2O3+OH-═AlO2-+H2O | |
| D. | 稀硝酸溶液中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 燃料电池的燃料都在负极发生氧化反应 | |
| D. | Fe3O4俗称铁红,常做红色油漆和涂料 |
| A. | N2 | B. | O2 | C. | .NaCl | D. | H2SO4溶液 |
 B.乙烯
B.乙烯
 2NH3
2NH3 如图为两套实验装置.
如图为两套实验装置.