��Ŀ����
3��ij��ѧС��ģ�ҵ������ȡHNO3���ͼ1��ʾװ�ã�����aΪһ���ɳ��������������Ƥ����ش���������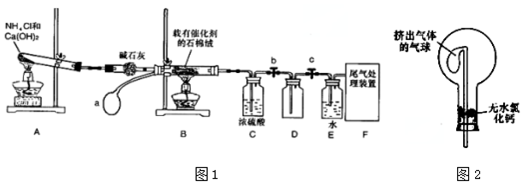
��1��д��װ��B����Ҫ��Ӧ�Ļ�ѧ����ʽ4NH3+5O2$\frac{\underline{\;����\;}}{��}$4NO+6H2O��
��2��װ��E����Ҫ��Ӧ�Ļ�ѧ����ʽ3NO2+H2O=2HNO3+NO��4NO2+2H2O+O2=4HNO3��
��3��װ��C��ŨH2SO4�����������ն����NH3��
��4����������û�ѧС�����ʵ������ȡNH3����һ������������Ũ��ˮ��ȡNH3��������NaOH��CaO�����ϵμ�Ũ��ˮ��ȡNH3����
��5��װ��D�е���Ҫ�������ռ����壮
��6��������еļ�ʯ�����ڸ���NH3��ijͬѧ˼���Ƿ������ˮ�Ȼ��ƴ����ʯ�ң��������ͼ2��ʾװ�ã������̶�װ��ʡ��δ����������֤��ʵ�鲽�����£�
������ƿ�ռ�������İ���������������ͼ��ʾ��������
��������ƿ��ʹ��ˮ�Ȼ��ƹ��廬����ƿ�ײ���ҡ�������Թ۲쵽���������������ͣ��ɴˣ���ͬѧ�ó����ۣ�������CaCl2�����ʯ�ң�
���� ����ʵ��װ��ͼ��Aװ����ʵ������ȡ������װ�ã�Bװ��Ϊ�����������ڴ�����������������NO��װ�ã�Cװ�����ն���İ�����װ�����������������ɵ�NO������Ϊ����������Eװ��Ϊ����������ˮ��Ӧ���������װ�ã�Fװ������β����
��1��װ��B��Ϊ�����������ķ�Ӧ��
��2��װ��E��Ϊ����������ˮ�ķ�Ӧ��
��3��װ��B����δ��Ӧ��İ�����װ��C����δ��Ӧ��İ�����
��4����������Ũ��ˮ�ֽ���ȡ��������NaOH��CaO�����ϵμ�Ũ��ˮ��ȡNH3��
��5��װ��D�����ռ������������壻
��6�������ܱ���ˮ�Ȼ������գ�ƿ��ѹǿ��С��
��� �⣺����ʵ��װ��ͼ��Aװ����ʵ������ȡ������װ�ã�Bװ��Ϊ�����������ڴ�����������������NO��װ�ã�Cװ�����ն���İ�����װ�����������������ɵ�NO������Ϊ����������Eװ��Ϊ����������ˮ��Ӧ���������װ�ã�Fװ������β����
��1��װ��B��Ϊ������������Ӧ����NO��ˮ�ķ�Ӧ��4NH3+5O2$\frac{\underline{\;����\;}}{��}$4NO+6H2O��
�ʴ�Ϊ��4NH3+5O2$\frac{\underline{\;����\;}}{��}$4NO+6H2O��
��2��װ��E�еķ�ӦΪ��3NO2+H2O=2HNO3+NO��4NO2+2H2O+O2=4HNO3��
�ʴ�Ϊ��3NO2+H2O=2HNO3+NO��4NO2+2H2O+O2=4HNO3��
��3��װ��CΪŨ���ᣬ����װ��B��δ��Ӧ�����İ�����
�ʴ�Ϊ�����ն����NH3��
��4��ʵ������ȡNH3��һ�����У���������Ũ��ˮ��ȡNH3��
��������NaOH��CaO�����ϵμ�Ũ��ˮ��ȡNH3��
�ʴ�Ϊ����������Ũ��ˮ��ȡNH3��������NaOH��CaO�����ϵμ�Ũ��ˮ��ȡNH3����
��5��װ��D�����ռ������������壬
�ʴ�Ϊ���ռ����壻
��6��������ƿ��ʹ��ˮ�Ȼ��ƹ��廬����ƿ�ײ���ҡ������������ˮ�Ȼ������գ�ѹǿ��С�������������ͣ�
�ʴ�Ϊ���������ͣ�
���� ������������Ʊ�Ϊ�����������˵��Ļ���������ʣ�Ӱ�컯ѧƽ������أ�ͬʱ������Ũ��������ʵ�����Ӧ�ã�

 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д� ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�| A�� | �÷�ɢϵ�ķ�ɢ��ΪFe2O3 | |
| B�� | ����NaOHʱ�����ķ�Ӧ����Ϊ��Fe2++2Fe3++8OH-=Fe3O4+4H2O | |
| C�� | �ڵ糡�����£�����������ɢϵ��ɫ�����˵���÷�ɢϵ������� | |
| D�� | ���ù��˵ķ�������ɫ������������Na+���뿪 |
| A�� | Na2S ��Һ�� c��OH-��=c��H+��+c��HS-��+2c��H2S�� | |
| B�� | Na2CO3��Һ�У�c��Na+��=2c��CO32-��+2c��HCO3-�� | |
| C�� | �����£�pH=1��CH3COOH��Һ��pH=13��NaOH��Һ�������ϣ���Һ������Ũ�ȵĴ�С˳��Ϊ��c��Na+����c��CH3COO-����c��OH-����c��H+�� | |
| D�� | 0.1mol•L-1��NaHC2O4��Һ��pH=4����c��H C2O4-����c��H+����c��H2C2O4����c��C2O42-�� |
| A�� | ʳ�︯�� | B�� | ֲ�������� | C�� | �������� | D�� | ʯ����ƶ��� |
| A�� | Si��SiO2��H2SiO3��Na2SiO3 | B�� | Fe��Fe��OH��3��Fe2O3��Fe��NO3��3 | ||
| C�� | HCl��Cl2��HClO��NaClO | D�� | Al��Al2O3��Al��OH��3��AlCl3 |
| A�� | ������Һ�������ֲ�ͬ������ | |
| B�� | ������Ũ�����ȥ�����е�ˮ���� | |
| C�� | ������һ���ж����壬������������ˮ��ɱ������ | |
| D�� | ���������Ļ�ѧ���ʺܻ��ã����Ǵ�����Һ�����ø�ƿ���� |
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=9.1��10-8 K2=1.1��10-12 | K1=7.5��10-3 K2=6.2��10-8 K3=2.2��10-13 |
| A�� | ̼�������ǿ�������� | |
| B�� | ��Ԫ�����������Ҫ�ɵ�һ��������� | |
| C�� | �����£���ˮϡ�ʹ��ᣬ$\frac{c��C{H}_{3}CO{O}^{-}��}{c��CHCOOH��•c��O{H}^{-}��}$���� | |
| D�� | ��������Һ�м�����NaOH��Һ�����볣������ |

 ��
��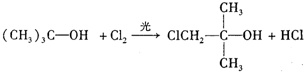 ����Ӧ���ͣ�ȡ����Ӧ��
����Ӧ���ͣ�ȡ����Ӧ�� ��
��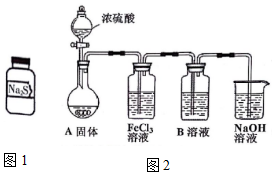 ����ƿ��ǩ�ѱ���ʴ��ҩƷ��ֻ������Na2S����������ͼ1����ÿƿҩƷ������Na2S��Na2SO3��Na2S2O3��Na2SiO3��Na2SO4�е�һ�֣�����ƿҩƷ�ֱ���ΪA��B��
����ƿ��ǩ�ѱ���ʴ��ҩƷ��ֻ������Na2S����������ͼ1����ÿƿҩƷ������Na2S��Na2SO3��Na2S2O3��Na2SiO3��Na2SO4�е�һ�֣�����ƿҩƷ�ֱ���ΪA��B��