题目内容
19.根据等电子原理,下列各组分子或离子的空间构型不相似的是( )| A. | NH4+和CH4 | B. | H3O+和NH3 | C. | NO3-和CO32- | D. | CO2和H2O |
分析 互为等电子体的微粒具有相似的空间构型.等电子原理:具有相同原子数和价电子数的微粒互称为等电子体.抓住等电子体的特点进行分析、判断,即可解答.
解答 解:A.NH4+和CH4的原子个数都为5;NH4+的价电子数为5+1×4-1=8,CH4的价电子数为4+1×4=8,二者含有相同原子数和相同价电子数,是等电子体,结构相似,故A不选;
B.H3O+和NH3的原子个数都为4;H3O+的价电子数为1×3+6-1=8,NH3的价电子数为5+1×3=8,二者含有相同原子数和相同价电子数,是等电子体,结构相似,故B不选;
C.NO3-和CO32-的原子个数都为4;NO3-的价电子数为5+6×3+1=24,CO32-的价电子数为4+6×3+2=24,二者含有相同原子数和相同价电子数,是等电子体,结构相似,故C不选;
D.CO2和H2O的原子个数都为3;CO2的价电子数为4+6×2=16,H2O的价电子数为1×2+6=8,二者含有相同原子数,但价电子数不相同,不是等电子体,结构不相似,前者为直线型,后者为V型,故D选;
故选D.
点评 本题考查了等电子体,解答本题的关键是要充分理解等电子体的本质特征,等电子体结构相似,题目难度中等.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
9.常温下,向10mL0.1mol•L-1的HR溶液中0.1mol•L-1的氨水,下列分析不正确的是( )
| A. | 开始滴加氨水后溶液导电能力逐渐增强,说明HR为弱酸 | |
| B. | 滴入10mL氨水后酸碱恰好中和,此时溶液pH=7 | |
| C. | 随若氨水的加入,当c(OH-)>c(H+)时,c(NH4+)>(R-) | |
| D. | 该过程中溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
10.基态时,某原子核外被电子占据的轨道共9个,其中有7个轨道已经被电子占满,这种元素是( )
| A. | Si | B. | P | C. | S | D. | Cl |
7.某化学兴趣小组根据部分物质的性质,设计了以下的实验流程:
①Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3
②S$\stackrel{O_{2}/点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO3
③Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3$\stackrel{△}{→}$无水FeCl3
下列判断正确的是( )
①Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3
②S$\stackrel{O_{2}/点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO3
③Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3$\stackrel{△}{→}$无水FeCl3
下列判断正确的是( )
| A. | 步骤①②中的SO2气体和CO2气体可以用澄清石灰水溶液鉴别 | |
| B. | 步骤③中,检验FeCl3(aq)溶液中是否存有Fe2+,应该选用KSCN溶液 | |
| C. | 三个步骤中都没有氧化还原反应 | |
| D. | 常温下,H2SO3溶液中通入少量氯气,溶液pH减小,Kw不变 |
11.下列图示与对应的叙述不相符合的是( )
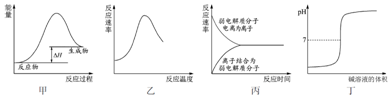

| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示强碱滴定强酸的滴定曲线 |