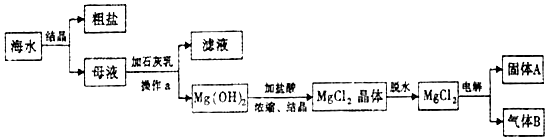
题目内容
11.已知2H2(g)+O2(g)=2H2O(l)+571.6KJ.下列说法错误的是( )| A. | 2mol液态水完全分解成氢气与氧气,需吸收571.6KJ热量 | |
| B. | 2mol氢气与1mol氧气的总能量大于2mol 液态水的总能量 | |
| C. | 2 g 氢气与16 g氧气完全反应生成18g液态水放出285.8 KJ热量 | |
| D. | 2mol氢气与1mol氧气完全反应生成水蒸汽放出的热量大于571.6KJ |
分析 由2H2(g)+O2(g)=2H2O(l)+571.6KJ可知,该反应为放热反应,化学计量数表示物质的量,互为逆反应时,焓变的数值相同、符号相反,以此来解答.
解答 解:A.由信息可知生成2molH2O(l)放热为571.6KJ,则2mol液态水完全分解成氢气与氧气,需吸收571.6KJ热量,故A正确;
B.为放热反应,则2mol氢气与1mol氧气的总能量大于2mol 液态水的总能量,故B正确;
C.物质的量与热量成正比,则2 g 氢气与16 g氧气完全反应生成18g液态水放出285.8 KJ热量,故C正确;
D.气态水的能量比液态水的能量高,则2mol氢气与1mol氧气完全反应生成水蒸汽放出的热量小于571.6KJ,故D错误;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、热化学方程式的意义为解答的关键,侧重分析与应用能力的考查,注意物质的状态、物质的量与热量的关系,题目难度不大.

练习册系列答案
相关题目
19.合成氨反应过程中的能量变化如图所示,下列说法错误的是( )
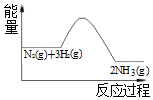

| A. | 反应体系中加入催化剂,不会改变反应的热效应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应的热化学方程式为 3H2+N2?2NH3+Q(Q>0) | |
| D. | 该反应是放热反应 |
6.下列属于原子晶体的化合物是( )
| A. | 干冰 | B. | 晶体硅 | C. | 金刚石 | D. | 碳化硅 |
16.物质的量浓度相同的三种溶液:①氯化铵、②氨水、③硫酸氢铵,c(NH4+)大小顺序正确的是( )
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ③>①>② |
1.下列溶液中,不能区别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液.
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液.
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①③ |

 .
.