题目内容
16.物质的量浓度相同的三种溶液:①氯化铵、②氨水、③硫酸氢铵,c(NH4+)大小顺序正确的是( )| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ③>①>② |
分析 硫酸氢铵电离产生NH4+,且氢离子抑制铵根离子水解;氯化铵电离生成NH4+,且铵根离子水解程度很弱;氨水电离程度很小,NH4+生成的浓度最小,以此来解答.
解答 解:③中氢离子抑制铵根离子水解,铵根离子浓度最大;①中电离生成NH4+,且铵根离子水解程度很弱;②中氨水电离程度很小,NH4+生成的浓度最小,则c(NH4+)大小顺序为③>①>②,
故选D.
点评 本题考查离子浓度大小的比较,为高频考点,把握电离与水解比较离子浓度为解答的关键,侧重分析与应用能力的考查,注意电离及水解的程度不大,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
7.下列实验装置或方案不能达到实验目的是( )
| 编号 | A | B | C | D |
| 实验装置或 方案 | 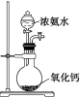 | 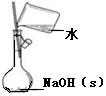 | 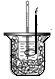 50mL0.5mol/LHCl与50mL0.55mol/LNaOH溶液 |  |
| 目的 | 制备少量氨气 | 配制0.10mol/L NaOH溶液 | 测定中和热 | 探究Ksp(AgCl)与Ksp(AgI)的大小 |
| A. | A | B. | B | C. | C | D. | D |
4.某小组设计如图装置研究电化学原理,下列说法中错误的是( )


| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| C. | 若开始时开关K与b连接,则该装置是化学能转变为电能 | |
| D. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 |
11.已知2H2(g)+O2(g)=2H2O(l)+571.6KJ.下列说法错误的是( )
| A. | 2mol液态水完全分解成氢气与氧气,需吸收571.6KJ热量 | |
| B. | 2mol氢气与1mol氧气的总能量大于2mol 液态水的总能量 | |
| C. | 2 g 氢气与16 g氧气完全反应生成18g液态水放出285.8 KJ热量 | |
| D. | 2mol氢气与1mol氧气完全反应生成水蒸汽放出的热量大于571.6KJ |
1.下列说法中正确的是( )
| A. | 得乙烯进入酸性KMnO4溶液和溴水,实验现象和反应类型相同 | |
| B. | 从苯的分子组成看苯远没有达到饱和,所以它应该能使溴的CCl4溶液褪色 | |
| C. | 苯环上的碳碳键是一种介于碳碳单链和碳碳双键之间的独特的键,但苯可以发生取代反应和加成反应 | |
| D. | 常温下,所有的碳原子数大于等于5的烷烃都不是气体 |
6.将4mol A气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)=2C(g),若经2s后测得C的物质的量为0.6mol.下列叙述正确的是( )
| A. | 用物质C表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 反应开始到2 s,物质B的物质的量浓度减少了0.85 mol/L | |
| C. | 2 s时物质A的转化率为15% | |
| D. | 2v(A)=v(B) |
3.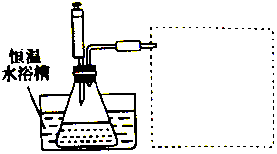 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
(1)V1=4;若V2=5,t3<t1,则由实验①、③可以得出的结论是增大催化剂浓度,可加快反应速率.
(2)实验②中0~5s内用H2O2物质的量浓度表示的反应速率为$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$.
(3)在图的方框中绘制出相应的装置.
(4)有人认为Fe3+催化H2O2分解的过程可分为两个阶段:①2Fe3++H2O2=2Fe2++O2↑+2H+,写出第二个阶段反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
 某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:
某学习小组的同学利用实验的方法探究一定温度下,双氧水浓度、催化剂用量(浓度)对H2O2分解速率的影响,实验内容如表所示,实验装置如图所示:| 实验序号 | 参加反应的物质 | 收集amL(在标准状况下)O2所需时间/s | ||||
| 酸性Fe2(SO4)3溶液 | H2O2溶液 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 4 | 0.1 | 3 | 4 | 3 | t1 |
| ② | 4 | 0.1 | 2 | 4 | V1 | 5 |
| ③ | V2 | 0.1 | V3 | 4 | 2 | t3 |
(2)实验②中0~5s内用H2O2物质的量浓度表示的反应速率为$\frac{a}{560}mol•{L}^{-1}•{s}^{-1}$.
(3)在图的方框中绘制出相应的装置.
(4)有人认为Fe3+催化H2O2分解的过程可分为两个阶段:①2Fe3++H2O2=2Fe2++O2↑+2H+,写出第二个阶段反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
4.对于平衡体系mA(g)+nB(g)?pC(g)+qD(g)△H=bkJ/mol.下列结论中错误的是( )
| A. | 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持其它条件不变,如升高温度,D的体积分数增大,说明该反应的△H<0 |