题目内容
2.乙炔是一种重要的有机物化工原料,现以它为原料,设计如下转化关系图(部分产物、反应条件已略去),其中A是由等物质的量的乙炔、一氧化碳和水反应而得.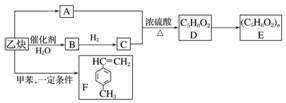
已知:物质R-CH═CH-OH不稳定,会自动转化R-CH2CHO.请回答下列问题:
(1)A分子中的官能团名称为碳碳双键、羧基.
(2)乙炔→F的反应类型是加成反应.
(3)E的结构简式为
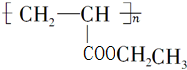 .
.(4)写出反应A+C→D的化学方程式:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCOOCH2CH3+H2O.
分析 乙炔与水加成生成B,B为CH3CHO,CH3CHO催化加氢生成C为CH3CH2OH,根据A和C反应的条件可知,该反应应为酯化反应,A是由等物质的量的乙炔、一氧化碳和水反应而得,则A为C3H4O2,根据D和E的分子式可知,D发生加聚反应生成E,所以可推知A为CH2=CHCOOH,所以D为CH2=CHCOOCH2CH3,E为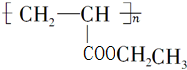 ,乙炔与甲苯发生加成反应生成F,以此来解答.
,乙炔与甲苯发生加成反应生成F,以此来解答.
解答 解:(1)A为CH2=CHCOOH,官能团名称为碳碳双键、羧基,故答案为:碳碳双键、羧基;
(2)乙炔→F,碳碳三键转化为双键,为炔烃的加成反应,故答案为:加成反应;
(3)E的结构简式为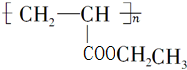 ,故答案为:
,故答案为: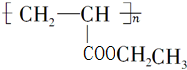 ;
;
(4)反应A+C→D的化学方程式为CH2=CHCOOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCOOCH2CH3+H2O,
故答案为:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCOOCH2CH3+H2O.
点评 本题考查有机物的合成及推断,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与推断能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
12.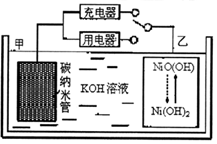 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 电池总反应为H2+2NiOOH$?_{放电}^{充电}$2Ni(OH)2 | |
| B. | 放电时,甲电极为负极,OH-移向乙电极 | |
| C. | 放电时,乙电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
13.下列说法正确的是( )
| A. | 按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 麻黄碱(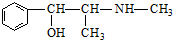 )的催化氧化产物能发生银镜反应 )的催化氧化产物能发生银镜反应 | |
| D. | 某分子式为C10H20O2的酯可发生如图所示的转化过程,则符合条件的酯的结构有4种 |
10.下列过程中,最终的白色沉淀不一定是BaSO4的是( )
| A. | Ba(NO3)2溶液$\stackrel{通入SO_{2}}{→}$白色沉淀 | |
| B. | 无色溶液$\stackrel{稀HNO_{3}}{→}$ $\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| C. | Ba(NO3)2溶液$\stackrel{加过量HCl}{→}$无现象 $\stackrel{Na_{2}SO_{4}}{→}$白色沉淀 | |
| D. | Fe(NO3)2溶液$\stackrel{加过量HCl}{→}$ $\stackrel{通入SO_{2}}{→}$ $\stackrel{BaCl_{2}}{→}$白色沉淀 |
17.下列反应的离子方程式书写正确的是( )
| A. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 惰性电极电解熔融氯化钠:2Clˉ+2H2O$\frac{\underline{\;电解\;}}{\;}$2OHˉ+H2↑+Cl2↑ | |
| C. | 等体积等物质的度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO32-+NH4+═BaCO3↓+NH3•H2O+H2O | |
| D. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ |
7.下列实验装置或方案不能达到实验目的是( )
| 编号 | A | B | C | D |
| 实验装置或 方案 | 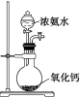 | 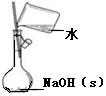 | 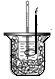 50mL0.5mol/LHCl与50mL0.55mol/LNaOH溶液 |  |
| 目的 | 制备少量氨气 | 配制0.10mol/L NaOH溶液 | 测定中和热 | 探究Ksp(AgCl)与Ksp(AgI)的大小 |
| A. | A | B. | B | C. | C | D. | D |
14.下列关于卤族元素结构和性质的说法错误的是( )
| A. | F、Cl、Br、I原子半径依次增大 | |
| B. | F、Cl、Br、I的电子层数逐渐增多 | |
| C. | F2、Cl2、Br2、I2的氧化性逐渐减弱 | |
| D. | F-、Cl-、Br -、I-离子的还原性依次减弱 |
11.已知2H2(g)+O2(g)=2H2O(l)+571.6KJ.下列说法错误的是( )
| A. | 2mol液态水完全分解成氢气与氧气,需吸收571.6KJ热量 | |
| B. | 2mol氢气与1mol氧气的总能量大于2mol 液态水的总能量 | |
| C. | 2 g 氢气与16 g氧气完全反应生成18g液态水放出285.8 KJ热量 | |
| D. | 2mol氢气与1mol氧气完全反应生成水蒸汽放出的热量大于571.6KJ |
10.我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,如图所示为海水综合利用部分流程,有关说法正确的是( )
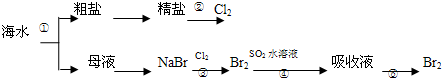

| A. | 上述工艺流程中涉及到化合、分解、复分解和置换反应 | |
| B. | ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2 | |
| C. | ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2 | |
| D. | ④中反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br- |