题目内容
9. 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:(1)A单质、B单质、化合物R的熔点大小顺序为下列的②(填序号)
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R>A单质; ④A单质>R>B单质.
(2)在CB3分子中C元素原子的原子轨道发生的是sp3杂化,其固体时的晶体类型为分子晶体.
(3)写出D原子的核外电子排布式1s22s22p63s23p4,C的氢化物比D的氢化物在水中溶解度大得多的可能原因氨气分子和水分子间能形成氢键且能发生化学反应.
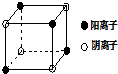
(4)如图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为1:1,FeD2物质中具有的化学键类型为离子键、共价键.
分析 A、B、C、D四种元素,B原子得一个电子后3p轨道全满,则B是Cl元素;A+比B-少一个电子层,则A是Na元素;C原子的p轨道中有3个未成对电子,则为第VA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,说明其氢化物中能和水形成分子间氢键,所以C是N元素;D的最高化合价和最低化合价的代数和为4,处于ⅥA族,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数,所以D是S元素;R是由A、D两元素形成的离子化合物,其中A与D离子的数目之比为2:1,则R是Na2S,据此解答.
解答 解:A、B、C、D四种元素,B原子得一个电子后3p轨道全满,则B是Cl元素;A+比B-少一个电子层,则A是Na元素;C原子的p轨道中有3个未成对电子,则为第VA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,说明其氢化物中能和水形成分子间氢键,所以C是N元素;D的最高化合价和最低化合价的代数和为4,处于ⅥA族,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数,所以D是S元素;R是由A、D两元素形成的离子化合物,其中A与D离子的数目之比为2:1,则R是Na2S.
(1)A单质、B单质、化合物R分别是Na、Cl2、Na2S,硫化钠是离子晶体,钠是金属晶体,固体氯气是分子晶体,金属Na的熔点很低,故晶体熔点高低顺序是:R>A单质>B单质,故选②;
(2)NCl3分子中氮原子含有3个共价单键且含有一个孤电子对,N原子采取sp3杂化,其固态时的晶体中构成微粒是分子,所以晶体类型为分子晶体,
故答案为:sp3;分子晶体;
(3)D是S元素,原子的核外电子排布式1s22s22p63s23p4,C的氢化物是NH3,D的氢化物是H2S,氨气分子和水分子间能形成氢键且能发生化学反应,导致氨气溶解性大于硫化氢,
故答案为:1s22s22p63s23p4;氨气分子和水分子间能形成氢键且能发生化学反应;
(4)FeS2晶体中阴离子数目为4×$\frac{1}{8}$=$\frac{1}{2}$、阳离子数目为4×$\frac{1}{8}$=$\frac{1}{2}$,故阴离子、阳离子数之比为1:1,FeS2物质中含有离子键,S22-含有共价键,
故答案为:1:1;离子键、共价键.
点评 本题是对物质结构和性质的考查,涉及晶体类型、熔沸点比较、核外电子排布、氢键、化学键、晶胞计算等,正确推断元素是解本题关键,难度中等.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案| A. | 达到反应限度时SO2的消耗速率必定等于SO3的生成速率相等 | |
| B. | 平衡时SO2、O2、SO3的分子数之比为2:1:2 | |
| C. | 平衡时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
| A. | SiO2与所有的酸都不能发生反应 | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | 过量的铜与浓硝酸反应能生成NO气体 | |
| D. | 加盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
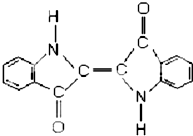
| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是 C16H10N2O2 | ||
| C. | 该物质是苯的同系物 | D. | 它含有碳碳双键、羰基等官能团 |
| A. | C2H5OH+3O2═2CO2+3H2O△H=-29.7 kJ/mol | |
| B. | C2H5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=-1366.2kJ/mol | |
| C. | C2 H5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol | |
| D. | C2H5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol |
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 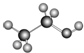 可以表示乙醇分子的球棍模型 可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
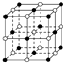 已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )| A. | 2Mx3d | B. | $\frac{M}{(2{x}^{3}d)}$ | C. | $\frac{4M}{({x}^{3}d)}$ | D. | $\frac{M}{({N}_{A}{x}^{3})}$ |
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 它们的氢化物的还原性随核电荷数的增加而增强 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
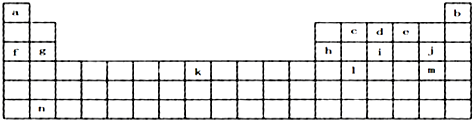
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族