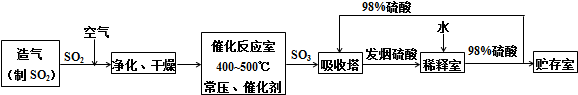
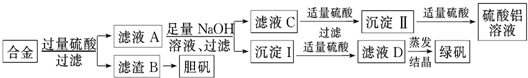
题目内容
研究性学习小组对某硫酸亚铁晶体(FeSO4?xH2O)热分解研究,该小组同学称取a g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值.
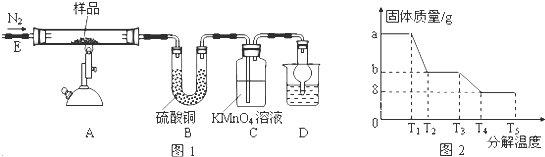
(1)检查整套装置气密性的操作及现象是 .
(2)装置B中硫酸铜粉末(足量)变蓝,质量增加12.6g,说明产物中有 ,装置C中稀高锰酸钾溶液褪色,说明产物中还有 .
(3)实验中要持续通入氮气,否则测出的x值 (填“偏大”、“偏小”或“不变”).
(4)硫酸亚铁晶体完全分解后装置A中还有残留红棕色固体,已知分解还生成另一物质SO3,写出FeSO4分解的化学方程式: .
(5)硫酸亚铁溶液敞口放在试剂瓶溶液会变黄,同时溶液中还有褐色沉淀,写出FeSO4溶液变质的化学方程式: .
(6)装置D中溶液为 ,球形干燥管的作用 .
(7)某研究所利用热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,制成固体质量-分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x= .

(1)检查整套装置气密性的操作及现象是
(2)装置B中硫酸铜粉末(足量)变蓝,质量增加12.6g,说明产物中有
(3)实验中要持续通入氮气,否则测出的x值
(4)硫酸亚铁晶体完全分解后装置A中还有残留红棕色固体,已知分解还生成另一物质SO3,写出FeSO4分解的化学方程式:
(5)硫酸亚铁溶液敞口放在试剂瓶溶液会变黄,同时溶液中还有褐色沉淀,写出FeSO4溶液变质的化学方程式:
(6)装置D中溶液为
(7)某研究所利用热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,制成固体质量-分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x=
考点:性质实验方案的设计
专题:实验设计题
分析:(1)检查装置的气密性原理是根据装置内外的压强差形成水柱或气泡,据此解答;
(2)水遇硫酸铜粉末(足量)变蓝,二氧化硫能使高锰酸钾溶液褪色;
(3)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,配平即可;
(5)硫酸亚铁溶液敞口放在试剂瓶溶液会变黄是因为亚铁被氧化成三价铁离子,同时溶液中还有褐色沉淀,说明生成了氢氧化铁的沉淀,据此书写方程式;
(6)装置D主要是吸收产生的过多二氧化硫气体防止污染空气,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸;
(7)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,根据原子守恒计算;
(2)水遇硫酸铜粉末(足量)变蓝,二氧化硫能使高锰酸钾溶液褪色;
(3)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,配平即可;
(5)硫酸亚铁溶液敞口放在试剂瓶溶液会变黄是因为亚铁被氧化成三价铁离子,同时溶液中还有褐色沉淀,说明生成了氢氧化铁的沉淀,据此书写方程式;
(6)装置D主要是吸收产生的过多二氧化硫气体防止污染空气,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸;
(7)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,根据原子守恒计算;
解答:
解:(1)检查装置气密性是否良好,用止水夹夹住E,微热硬质玻璃管,若D中管口处产生气泡,冷却后导管内液面升高,说明装置气密性良好,
故答案为:用止水夹夹住E,微热硬质玻璃管,若D中管口处产生气泡,冷却后导管内液面升高,说明装置气密性良好;
(2)水遇硫酸铜粉末(足量)变蓝,二氧化硫能使高锰酸钾溶液褪色,故答案为:水;二氧化硫;
(3)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,故答案为:偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,方程式为2FeSO4
Fe2O3+SO2↑+SO3↑,
故答案为:2FeSO4
Fe2O3+SO2↑+SO3↑;
(5)硫酸亚铁溶液敞口放在试剂瓶溶液会变黄是因为亚铁被氧化成三价铁离子,同时溶液中还有褐色沉淀,说明生成了氢氧化铁的沉淀,因此FeSO4溶液变质的化学方程式12FeSO4+3O2+6H2O═4Fe2(SO4)3+↓4Fe(OH)3↓,故答案为:12FeSO4+3O2+6H2O═4Fe2(SO4)3+4Fe(OH)3↓;
(6)装置D主要是吸收产生的过多二氧化硫气体防止污染空气,故用氢氧化钠溶液,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸,故答案为:氢氧化钠溶液;防止氢氧化钠溶液倒吸;
(7)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
故答案为:7.
故答案为:用止水夹夹住E,微热硬质玻璃管,若D中管口处产生气泡,冷却后导管内液面升高,说明装置气密性良好;
(2)水遇硫酸铜粉末(足量)变蓝,二氧化硫能使高锰酸钾溶液褪色,故答案为:水;二氧化硫;
(3)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,故答案为:偏小;
(4)FeSO4的分解后装置A中还有残留红棕色固体,即生成了氧化铁,又还生成另一物质SO3,根据氧化还原反应,还应该有化合价减低的产物SO2,方程式为2FeSO4
| ||
故答案为:2FeSO4
| ||
(5)硫酸亚铁溶液敞口放在试剂瓶溶液会变黄是因为亚铁被氧化成三价铁离子,同时溶液中还有褐色沉淀,说明生成了氢氧化铁的沉淀,因此FeSO4溶液变质的化学方程式12FeSO4+3O2+6H2O═4Fe2(SO4)3+↓4Fe(OH)3↓,故答案为:12FeSO4+3O2+6H2O═4Fe2(SO4)3+4Fe(OH)3↓;
(6)装置D主要是吸收产生的过多二氧化硫气体防止污染空气,故用氢氧化钠溶液,球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸,故答案为:氢氧化钠溶液;防止氢氧化钠溶液倒吸;
(7)通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:2x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
故答案为:7.
点评:本题主要考查了学生根据实验原理从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力等,难度较大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+,进行如下实验:
(1)取该溶液100mL,加入过量NaOH溶液,加热,得到0.01 mol 气体,同时产生红褐色沉淀;过滤,将沉淀洗涤,灼烧,得到0.8 g固体;
(2)向(1)的滤液中通入足量CO2,过滤,得到0.01 mol沉淀;
(3)向(2)的滤液中加入足量用盐酸酸化的BaCl2溶液,得到2.33g沉淀,
由此可知原溶液中( )
(1)取该溶液100mL,加入过量NaOH溶液,加热,得到0.01 mol 气体,同时产生红褐色沉淀;过滤,将沉淀洗涤,灼烧,得到0.8 g固体;
(2)向(1)的滤液中通入足量CO2,过滤,得到0.01 mol沉淀;
(3)向(2)的滤液中加入足量用盐酸酸化的BaCl2溶液,得到2.33g沉淀,
由此可知原溶液中( )
| A、至少存在CO32-、Cl-中的一种 |
| B、Cl-一定存在,K+可能存在 |
| C、Cl-一定存在,且c(Cl-)≥0.6mol?L-1 |
| D、溶液中至少存在4种离子 |


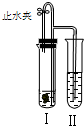 如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行实验(图中铁架台等仪器均已略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )