题目内容
硫酸是重要的工业三酸之一.硫酸的产量和用量与一个国家的化学工业水平有着非常密切的关系.在硫酸工业生产中,往往涉及化学反应原理、原料、能源、设备、工艺流程、环保、经济效益等许多问题.根据硫酸的工业生产原理,其生产过程如图所示:
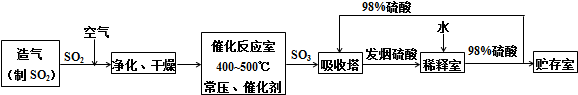
请回答下列问题:
(1)写出催化反应室中将SO2氧化成SO3的化学方程式 .
(2)早期生产中,SO2的制取以黄铁矿为原料.近些年来,很多国家已经限制以黄铁矿为原料制硫酸,其主要原因是 .
(3)在以上图示的某一生产过程中,利用了热交换的原理.请你运用反应速率和化学平衡原理,从节约能源、降低生产成本、提高原料转化率的角度加以解释 .
(4)吸收塔排除的烟气中含有危害环境的SO2,生产中常用烧碱溶液吸收处理.若用10.0L A 5.00mol?L-1烧碱溶液完全吸收20.0m3(标准状况)尾气中的SO2后,所得溶液中含有NaHSO3和Na2SO3的物质的量比为1:2,则尾气中SO2的体积分数为 .
(5)农用磷肥过磷酸钙[主要成份:CaSO4和Ca(H2PO4)2],常用磷矿石[主要成份:Ca3(PO4)2]和浓硫酸共热制取.用10.0t 98%的浓硫酸与足量的磷矿石作用,理论上可得过磷酸钙 t.

请回答下列问题:
(1)写出催化反应室中将SO2氧化成SO3的化学方程式
(2)早期生产中,SO2的制取以黄铁矿为原料.近些年来,很多国家已经限制以黄铁矿为原料制硫酸,其主要原因是
(3)在以上图示的某一生产过程中,利用了热交换的原理.请你运用反应速率和化学平衡原理,从节约能源、降低生产成本、提高原料转化率的角度加以解释
(4)吸收塔排除的烟气中含有危害环境的SO2,生产中常用烧碱溶液吸收处理.若用10.0L A 5.00mol?L-1烧碱溶液完全吸收20.0m3(标准状况)尾气中的SO2后,所得溶液中含有NaHSO3和Na2SO3的物质的量比为1:2,则尾气中SO2的体积分数为
(5)农用磷肥过磷酸钙[主要成份:CaSO4和Ca(H2PO4)2],常用磷矿石[主要成份:Ca3(PO4)2]和浓硫酸共热制取.用10.0t 98%的浓硫酸与足量的磷矿石作用,理论上可得过磷酸钙
考点:工业制取硫酸
专题:元素及其化合物
分析:(1)SO2氧化成SO3;
(2)很多国家已经限制以黄铁矿为原料制硫酸,因为废弃物太多,处理成本高;
(3)热交换的原理分析;
(4)根据NaHSO3和Na2SO3的物质的量的关系进行计算;
(5)根据浓硫酸与足量的磷矿石反应的化学方程式进行计算.
(2)很多国家已经限制以黄铁矿为原料制硫酸,因为废弃物太多,处理成本高;
(3)热交换的原理分析;
(4)根据NaHSO3和Na2SO3的物质的量的关系进行计算;
(5)根据浓硫酸与足量的磷矿石反应的化学方程式进行计算.
解答:
解:(1)催化反应室中将SO2氧化成SO3的化学方程式为2SO2+O2
2SO3,故答案为:2SO2+O2
2SO3;
(2)近些年来,很多国家已经限制以黄铁矿为原料制硫酸,其主要原因是黄铁矿煅烧时产生氧化铁、不反应杂质、有害气体等众多废弃物,治理成本太高;
故答案为:废弃物太多,处理成本高;
(3)利用了热交换的原理,反应产生的热量预热原料气(SO2和O2),能加快反应速率,节约能源;同时降低反应后混合物的温度,有利于化学平衡向正反应方向移动,提高原料转化率;
故答案为:热交换利用反应产生的热量预热原料气(SO2和O2),加快反应速率,节约能源;同时降低反应后混合物的温度,有利于化学平衡2SO2+O2
2SO3向生成SO3的方向移动,提高原料转化率;
(4)10.0L 5.00mol?L-1烧碱溶液中,n(NaOH)=50mol,再根据NaHSO3和Na2SO3的物质的量比为1:2,可知x+2x=50mol,x=
mol,含SO2为2x=
mol,
×100%=3.36%;
故答案为:3.36%;
(5)根据反应:Ca3(PO4)2+2H2SO4=2CaSO4+Ca(H2PO4)2,
2×98 2×136+234
10.0t×98% x
=
,x=25.3t;
故答案为:25.3.
| ||
| 高温高压 |
| ||
| 高温高压 |
(2)近些年来,很多国家已经限制以黄铁矿为原料制硫酸,其主要原因是黄铁矿煅烧时产生氧化铁、不反应杂质、有害气体等众多废弃物,治理成本太高;
故答案为:废弃物太多,处理成本高;
(3)利用了热交换的原理,反应产生的热量预热原料气(SO2和O2),能加快反应速率,节约能源;同时降低反应后混合物的温度,有利于化学平衡向正反应方向移动,提高原料转化率;
故答案为:热交换利用反应产生的热量预热原料气(SO2和O2),加快反应速率,节约能源;同时降低反应后混合物的温度,有利于化学平衡2SO2+O2
| ||
| 高温高压 |
(4)10.0L 5.00mol?L-1烧碱溶液中,n(NaOH)=50mol,再根据NaHSO3和Na2SO3的物质的量比为1:2,可知x+2x=50mol,x=
| 50 |
| 3 |
| 100 |
| 3 |
| 100/3×22.4L |
| 20.0×103L |
故答案为:3.36%;
(5)根据反应:Ca3(PO4)2+2H2SO4=2CaSO4+Ca(H2PO4)2,
2×98 2×136+234
10.0t×98% x
| 2×98 |
| 10.0t×98% |
| 2×136+234 |
| x |
故答案为:25.3.
点评:本题是一道综合性的考题,涉及化学反应速率、化学平衡常数、化学平衡的移动以及v-t图的知识,难度较大,综合性强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列对常用仪器的表述正确的是( )
| A、用NaCl固体和浓硫酸各自配制0.5mol.L-1的溶液,所用仪器完全相同 |
| B、酸式滴定管注入NaHCO3溶液之前应进行捡漏、洗涤和润洗 |
| C、过滤、溶解、蒸发操作中都需要使用玻璃棒 |
| D、用小试管和胶头滴管不能鉴别出Na2CO3溶液、稀盐酸、Ba(OH)2溶液、酚酞试液 |
下列实验方案正确且能达到相应实验预期目的且安全的是( )
A、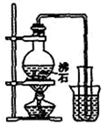 制取少量蒸馏水 |
B、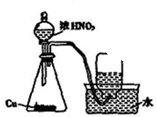 用铜和浓硝酸制取少量NO3 |
C、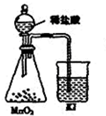 比较MnO2、Cl2、I2的氧化性 |
D、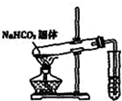 探究NaHCO3的热稳定性 |
下列各组数据中,其比值为2:1的是( )
| A、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| B、相同温度下,1 mol.L-1醋酸与0.5mol.L-1醋酸中c(H+)之比 |
| C、用同浓度盐酸中和相同体积pH均为12的Ba(OH)2和KOH,所需盐酸的体积之比 |
| D、pH=2的H2SO4溶液与pH=2的CH3COOH溶液中,c(CH3COOH):c(H2SO4) |
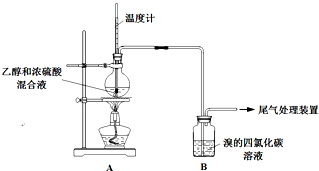 实验室制乙烯时,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用如图实验验证.(气密性已检验,部分夹持装置略).
实验室制乙烯时,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用如图实验验证.(气密性已检验,部分夹持装置略).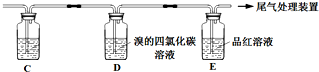
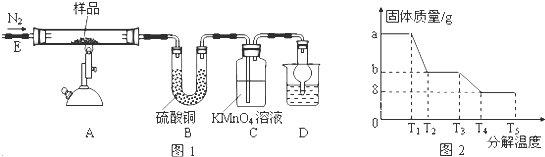
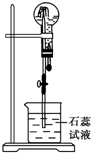 物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B.按如图所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B.按如图所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
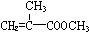 ) 合成路线的一部分.现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6MPa条件下羰基化,一步制得
) 合成路线的一部分.现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6MPa条件下羰基化,一步制得 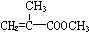 ,其化学方程式为:
,其化学方程式为: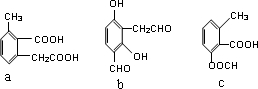 .
.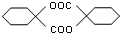 ,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)
,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)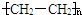 .
.