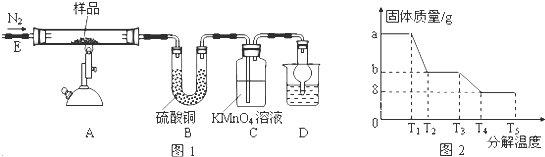
题目内容
某校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的硫酸铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),其实验方案如下: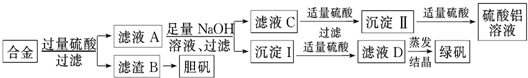
请回答下列问题:
(1)过滤用的玻璃仪器有 .
(2)写出由沉淀Ⅱ转化为硫酸铝溶液的离子方程式 ;滤液C转化成沉淀Ⅱ时,硫酸的用量不易控制,可改用 .
(3)兴趣小组提出以下两种方案将滤渣B转化成胆矾晶体,你认为哪种方案更合适 .
①用浓硫酸与Cu在加热条件下反应生成硫酸铜
②在空气中加热铜生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜.
小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2来制备胆矾晶体,则该反应的总化学方程式为
(4)有同学提出可将方案中最初溶解合金的硫酸改用烧碱,重新设计方案,也能最终制得三种物质,
你认为改进后的方案相对于原方案 (填“更合理”或“不合理”),理由是 .

请回答下列问题:
(1)过滤用的玻璃仪器有
(2)写出由沉淀Ⅱ转化为硫酸铝溶液的离子方程式
(3)兴趣小组提出以下两种方案将滤渣B转化成胆矾晶体,你认为哪种方案更合适
①用浓硫酸与Cu在加热条件下反应生成硫酸铜
②在空气中加热铜生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜.
小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2来制备胆矾晶体,则该反应的总化学方程式为
(4)有同学提出可将方案中最初溶解合金的硫酸改用烧碱,重新设计方案,也能最终制得三种物质,
你认为改进后的方案相对于原方案
考点:金属的回收与环境、资源保护
专题:几种重要的金属及其化合物
分析:(1)根据过滤实验用到的仪器来回答;
(2)合金与硫酸反应生成铝和铁的硫酸盐,滤渣为铜单质,滤液A与足量氢氧化钠反应,把铝盐转化为偏铝酸盐,氢氧化铁沉淀出来,故滤液C为偏铝酸钠,加入适量硫酸得氢氧化铝沉淀,据此得解;
(3)依据反应原理分析即可;根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(4)根据实验中的酸和碱的量的情况来对比回答.
(2)合金与硫酸反应生成铝和铁的硫酸盐,滤渣为铜单质,滤液A与足量氢氧化钠反应,把铝盐转化为偏铝酸盐,氢氧化铁沉淀出来,故滤液C为偏铝酸钠,加入适量硫酸得氢氧化铝沉淀,据此得解;
(3)依据反应原理分析即可;根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(4)根据实验中的酸和碱的量的情况来对比回答.
解答:
解:(1)过滤实验用到的仪器有:滤纸、铁架台、铁圈、烧杯、玻璃棒和漏斗,故答案为:烧杯、漏斗、玻璃棒;
(2)合金与硫酸反应生成硫酸铝,硫酸铝与足量氢氧化钠反应,硫酸铝转化为偏铝酸钠,加入适量硫酸,偏铝酸钠生成氢氧化铝沉淀,离子反应方程式为:Al(OH)3+3H+═Al3++3H2O,此过程不易控制,故可改用向滤液中加入弱酸即通入足量的二氧化碳气体,
故答案为:Al(OH)3+3H+═Al3++3H2O;向滤液中通入足量的二氧化碳气体;
(3)铜与浓硫酸反应生成有毒有污染的二氧化硫气体,若铜先和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,所以途径②最佳,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O,
故答案为:②;Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O;
(4)在实验原方案中,需要的是适量的酸,且步骤繁琐,这很难控制,改用烧碱,首先分离出来铝,然后加入硫酸,分离出铁,最后得铜的化合物,故比较合理,
故答案为:更合理; 原方案操作步骤多、时间长、消耗试剂量过大.
(2)合金与硫酸反应生成硫酸铝,硫酸铝与足量氢氧化钠反应,硫酸铝转化为偏铝酸钠,加入适量硫酸,偏铝酸钠生成氢氧化铝沉淀,离子反应方程式为:Al(OH)3+3H+═Al3++3H2O,此过程不易控制,故可改用向滤液中加入弱酸即通入足量的二氧化碳气体,
故答案为:Al(OH)3+3H+═Al3++3H2O;向滤液中通入足量的二氧化碳气体;
(3)铜与浓硫酸反应生成有毒有污染的二氧化硫气体,若铜先和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,所以途径②最佳,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O,
故答案为:②;Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O;
(4)在实验原方案中,需要的是适量的酸,且步骤繁琐,这很难控制,改用烧碱,首先分离出来铝,然后加入硫酸,分离出铁,最后得铜的化合物,故比较合理,
故答案为:更合理; 原方案操作步骤多、时间长、消耗试剂量过大.
点评:本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
下列实验方案正确且能达到相应实验预期目的且安全的是( )
A、 制取少量蒸馏水 |
B、 用铜和浓硝酸制取少量NO3 |
C、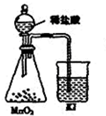 比较MnO2、Cl2、I2的氧化性 |
D、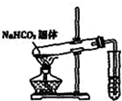 探究NaHCO3的热稳定性 |
下列说法正确的是( )
| A、Al在氧气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| B、铜的金属活动性比铝弱,可用铜罐代替铝罐储运浓硝酸 |
| C、明矾可用于除去酸性废水中的悬浮颗粒 |
| D、用高纯度的二氧化硅制作的光导纤维遇强碱会“断路” |
下列说法不正确的是( )
| A、用石灰石或石灰乳进行燃煤烟气脱硫(除SO2)可获得副产品石膏 |
| B、金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法 |
| C、若在水里贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 |
| D、常温时,某可逆反应的平衡常数越大则其反应速率就越快 |
下列说法正确的是( )
| A、工业制漂白粉是将氯气通入石灰水中制备 |
| B、海水中提取溴的方法是在经处理得到的含溴单质的水中鼓入热空气或水蒸气使溴单质挥发出来 |
| C、硫粉在过量的纯氧中燃烧可以生成三氧化硫 |
| D、少量二氧化碳通入氯化钙溶液中能生成白色沉淀 |
下列各组数据中,其比值为2:1的是( )
| A、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| B、相同温度下,1 mol.L-1醋酸与0.5mol.L-1醋酸中c(H+)之比 |
| C、用同浓度盐酸中和相同体积pH均为12的Ba(OH)2和KOH,所需盐酸的体积之比 |
| D、pH=2的H2SO4溶液与pH=2的CH3COOH溶液中,c(CH3COOH):c(H2SO4) |