题目内容
20.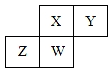 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | ZY2晶体熔化、液态Y3气化均需克服分子间作用力 |
分析 根据短周期元素X、Y、Z、W在元素周期表中的相对位置知,X和Y位于第二周期而Z和W位于第三周期,其中W原子的质子数是其最外层电子数的三倍,设W最外层电子数为a,则10+a=3a,a=5,所以W是P元素,则X是N、Y是O、Z是Si元素,
A.原子电子层数越多,其原子半径越大;同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
C.元素的非金属性越强,其简单氢化物的稳定性越强;
D.SiO2是原子晶体、O3是分子晶体.
解答 解:根据短周期元素X、Y、Z、W在元素周期表中的相对位置知,X和Y位于第二周期而Z和W位于第三周期,其中W原子的质子数是其最外层电子数的三倍,设W最外层电子数为a,则10+a=3a,a=5,所以W是P元素,则X是N、Y是O、Z是Si元素,
A.原子电子层数越多,其原子半径越大;同一周期元素,原子半径随着原子序数增大而减小,所以原子半径Z>W>X>Y,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,非金属性X>W>Z,则最高价氧化物对应水化物的酸性:X>W>Z,故B正确;
C.元素的非金属性越强,其简单氢化物的稳定性越强,非金属性Y>X>W>Z,则最简单气态氢化物的热稳定性:Y>X>W>Z,故C正确;
D.SiO2是原子晶体、O3是分子晶体,原子晶体熔融时破坏化学键、分子晶体熔融时破坏分子间作用力,所以ZY2晶体熔化、液态Y3气化时前者破坏化学键、后者破坏分子间作用力,故D错误;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,涉及原子半径、最高价含氧酸酸性强弱判断、氢化物稳定性强弱判断等知识点,侧重考查学生分析推断、元素周期律的灵活运用,注意规律中的反常现象,如O、F元素没有最高价含氧酸,题目难度不大.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | 氧化性 | B. | 还原性 | C. | 碱性 | D. | 酸性 |

| A. | 图甲:进行中和热的测定 | |
| B. | 图乙:比较 HCl、H2CO3和 H2SiO3 的酸性强弱 | |
| C. | 图丙:验证 CuCl2对 H2O2 分解有催化作用 | |
| D. | 图丁:验证 2NO2(g)?N2O4(g)△H<0 |
| A. | 被测样品中含有加热不挥发的杂质 | B. | 被测样品中含有加热易挥发的杂质 | ||
| C. | 实验前被测样品已有部分失水 | D. | 加热前所用的坩埚未完全干燥 |
| A. | 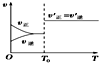 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 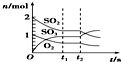 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |

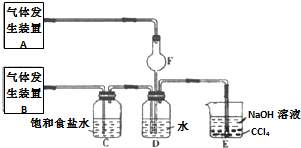
 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
.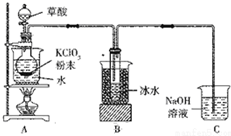 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示: