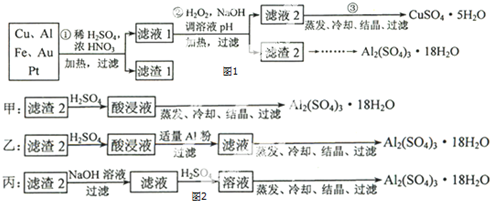
题目内容
12.(1)资源必须要合理使用.①水是一种宝贵的资源,保护水资源就是保护我们的生命.下列做法不利于水资源保护的是B(填字母代号)
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于可回收物(填“可回收物”或“可堆肥垃圾”);
③在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染.在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2.
(2)保护环境、爱护地球已成为人们的共同呼声.
①我们常在公共场所见到下列标志,其中属于回收标志的是B

②2014年1月,教育部规定在学校公共场所禁止吸烟.下列有关说法中,不正确的是C.
A.吸烟会对室内和公共场所造成污染
B.吸入焦油、尼古丁及颗粒物可导致多种病变
C.N2、CO2、CO尼古丁和都属于室内空气污染物
(3)化学与生活关系密切.现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①D是重要的体内能源;
②C广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(4)材料是人类赖以生存和发展的重要物质基础
①试管、烧杯和烧瓶等化学仪器的主要材质是A;
A.玻璃 B.陶瓷 C.水泥
②“辽宁号”航母的服役举世瞩目.钢铁是制造航母的主要材料.生铁和钢成分上的主要差别是A;
A.碳的含量不同 B.磷、硫的含量不同 C.镍、铬等金属含量不同
③钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为Fe-2e-=Fe2+.
分析 (1)①生活用水、工业废水、农药和化肥的不合理使用都能造成地下水的污染;
②矿泉水瓶是食品用塑料瓶,属于可回收物;
③可排入大气说明气体无污染,再结合氧化还原关系可知产物为氮气;
(2)①根据图表的意义进行分析解答即可;
②A.吸烟会产生有毒气体;
B.焦油、尼古丁及颗粒物会危害人体健康;
C.N2、CO2不属于室内空气污染物;
(3)油脂在人体内发生氧化反应生成释放大量能量;绿色植物中富含维生素C;
(4)①试管、烧杯和烧瓶等化学仪器的主要材质是玻璃;
②生铁和钢都是铁和碳的合金;
③钢铁发生电化学腐蚀时,铁做负极,失去电子生成亚铁离子.
解答 解:(1)①生活用水、工业废水、农药和化肥的不合理使用都能造成地下水的污染,因此科学合理使用农药、处理生活污水,达标排放是保护水资源的有效措施,
故答案为:B;
②矿泉水瓶的主要成分是聚对苯二甲酸乙二醇酯,是食品用塑料瓶,属于可回收物,
故答案为:可回收物;
③可排入大气说明气体无污染,反应前后C元素化合价升高,O元素化合价没变,因此N元素的化合价肯定降低,因此产物为氮气,则反应方程式为:2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2;
故答案为:2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2;
(2)①A.该图是可燃垃圾标志,故A错误;
B.该图是可回收标志,故B正确;
C.图为当心辐射标志,故C错误;
故答案为:B;
②A.吸烟会产生有毒气体,如CO等,所以吸烟会对室内和公共场所造成污染,故A正确;
B.焦油、尼古丁及颗粒物会危害人体健康,吸入焦油、尼古丁及颗粒物可导致多种病变,故B正确;
C.N2、CO2无毒,对人体无害,所以N2、CO2不属于室内空气污染物,故C错误;
故答案为:C;
(3)油脂在人体内发生氧化反应生成释放大量能量;绿色植物中富含维生素C,维生素C有酸性和还原性,又称为抗坏血酸;
①油脂是重要的体内能源;
②维生素C广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
故答案为:D;C;
(4)①试管、烧杯和烧瓶等化学仪器的主要材质是玻璃;
故答案为:A;
②生铁和钢都是铁和碳的合金,生铁中含碳量比钢中含碳量高,所以生铁和钢成分上的主要差别是碳的含量不同;
故答案为:A;
③钢铁发生电化学腐蚀时,铁做负极,失去电子生成亚铁离子,负极电极反应式为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+.
点评 本题考查资源、人体营养物质、环境保护、材料、电化学知识等,题目综合性强,难度中等,平时注意基础知识的积累,试题有利于培养学生的分析、理解能力及对基础知识的综合应用能力.

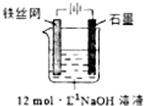 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有杀菌消毒、吸附悬浮物.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,放电时负极材料为Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-;.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
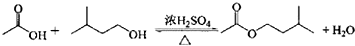
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g异戊醇、6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少最水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊脂3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸;洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号〕d.
a、直接将乙酸异戊酯从分液漏斗的上口倒出
b、直接将乙酸异戊从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酚从上口倒出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥乙酸异戊酯.
(6)在蒸馏操作中,仪器选择及安装都正确的是图2中的b(填标号).
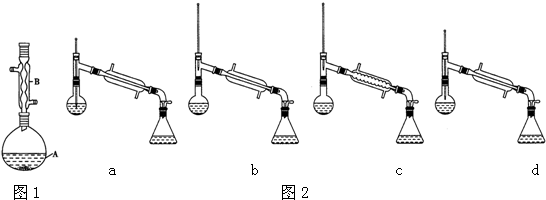
(7)本实验的产率是c(填标号).
a.30% b.40% c、60% d、90%
| A. | 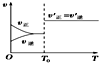 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 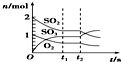 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
①在滤液中通入足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液;⑤过滤.
合理的操作顺序是( )
| A. | ②⑤①③④ | B. | ①③⑤②④ | C. | ①②③④⑤ | D. | ②①③⑤④ |
| A. | 低碳生活注重节能减排,减少温室气体的排放 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量 |
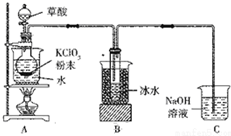 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示: