题目内容
18.某研究小组为了制备Na2S2O3,做了如下实验:已知Na2S2O3易溶于水,遇酸易分解.I.实验原理:Na3SO3(aq)+S(s)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)
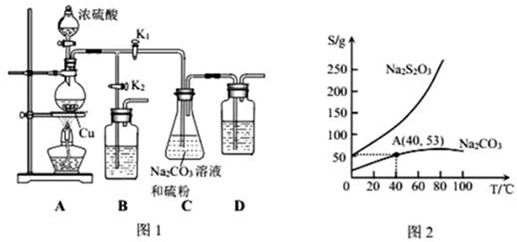
Ⅱ.实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
Ⅲ.实验步骤:
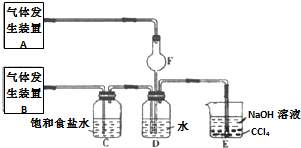
(1)检查装置气密性,按图1所示加入试剂,其中装置D的作用是吸收过量的SO2尾气,防止污染环境.写出C装置中发生的化学方程式:SO2+Na2CO3+S=Na2S2O3+CO2.
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热.
(4)将C中为40℃含50g水的饱和Na2S2O3•5H2O,可得Na2S2O3•5H2O62g.
分析 (1)由于浓硫酸和Cu片反应产生的SO2与C中的物质反应会有过量,B和D是为了吸收多余的二氧化硫;C中二氧化硫与碳酸钠以及硫混合反应生成Na2S2O3和二氧化碳,据此书写方程式;
(4)由图象2可知,40℃Na2CO3的溶解度为53g,所以50g水中有Na2CO3的物质的量为$\frac{\frac{53}{2}}{106}$=0.25mol,结合C中的反应:SO2+Na2CO3+S=Na2S2O3+CO2进行计算.
解答 解:(1)由于浓硫酸和Cu片反应产生的SO2与C中的物质反应会有过量,所以B和D可以用来吸收过量的SO2尾气,防止污染环境;C中通入的二氧化硫与碳酸钠以及硫混合反应生成Na2S2O3和二氧化碳,方程式为:SO2+Na2CO3+S=Na2S2O3+CO2;故答案为:吸收过量的SO2尾气,防止污染环境;SO2+Na2CO3+S=Na2S2O3+CO2;
(4)由图象2可知,40℃Na2CO3的溶解度为53g,所以50g水中有Na2CO3的物质的量为$\frac{\frac{53}{2}}{106}$=0.25mol,又根据C中的反应:SO2+Na2CO3+S=Na2S2O3+CO2可知,Na2CO3完全反应,所以Na2S2O3生成0.25mol,故可得Na2S2O3•5H2O质量为0.25mol×208g/mol=62g,故答案为:62.
点评 本题考查化学实验的制备、含量测定,涉及对尾气吸收、方程式的书写化学计算等知识,是对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
11.补血保健品含有Fe2+的物质,但同时也加入维生素C,加入维生素C是利用了它的( )
| A. | 氧化性 | B. | 还原性 | C. | 碱性 | D. | 酸性 |
6.硫酸铜结晶水含量测定的实验中,若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有( )
| A. | 被测样品中含有加热不挥发的杂质 | B. | 被测样品中含有加热易挥发的杂质 | ||
| C. | 实验前被测样品已有部分失水 | D. | 加热前所用的坩埚未完全干燥 |
3. 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有杀菌消毒、吸附悬浮物.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
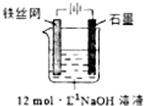
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,放电时负极材料为Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-;.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有杀菌消毒、吸附悬浮物.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,放电时负极材料为Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-;.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
10.氮氧化物废气是一种毒性很大的黄烟,不经治理通过烟囱排放到大气中,对生态环境和人类健康带来较大的威胁.工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),常见处理法有:
(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx$\frac{\underline{\;催化剂\;}}{\;}$(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如图1
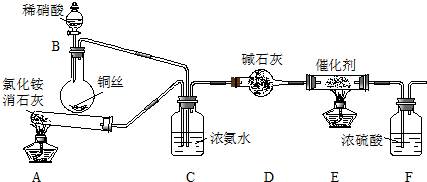
①装置A中发生反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②装置D中碱石灰的作用是除去气体中含有的水蒸气.
(2)用Na2CO3溶液吸收法处理NOx.
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3═2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3═NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是D(填字母).
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为1.875.
(3)用固体氧化物电解池通过电解方式分解NOx.当以Pt作电极时,固体氧化物电解池还原NO示意图如图2.
298K时,有关实验数据如下,(化学反应消耗的电能占总电能的80%)
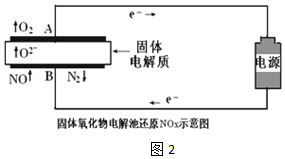
(实验所得数据均为多次平行试验的平均值)
①根据实验组1数据,NO分解的热化学方程式2NO(g)=N2(g)+O2(g)△H=+3.2akJ•mol-1
②实验组2明显比实验组1生成的N2少,其原因用电极反应式表示为O2+4e-=2O2-或2NO2+8e-=4O2-+N2.
(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx$\frac{\underline{\;催化剂\;}}{\;}$(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如图1

①装置A中发生反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②装置D中碱石灰的作用是除去气体中含有的水蒸气.
(2)用Na2CO3溶液吸收法处理NOx.
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3═2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3═NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是D(填字母).
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为1.875.
(3)用固体氧化物电解池通过电解方式分解NOx.当以Pt作电极时,固体氧化物电解池还原NO示意图如图2.
298K时,有关实验数据如下,(化学反应消耗的电能占总电能的80%)

| 实验序号 | B极气体 | 电路中通过电子 | 消耗总电能 | 生成N2 |
| 实验1 | NO | 1mol | a KJ | 0.25mol |
| 实验2 | NO和空气 (不考虑NO2) | 1mol | a KJ | 0.09mol |
①根据实验组1数据,NO分解的热化学方程式2NO(g)=N2(g)+O2(g)△H=+3.2akJ•mol-1
②实验组2明显比实验组1生成的N2少,其原因用电极反应式表示为O2+4e-=2O2-或2NO2+8e-=4O2-+N2.
7.如图所示与对应叙述相符合的是( )
| A. | 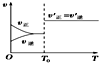 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 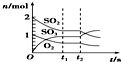 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
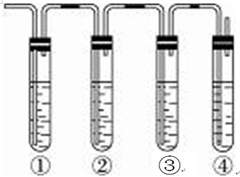 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题: