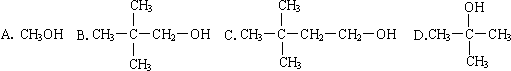题目内容
下列离子方程式书写正确的是( )
| A、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓ |
| C、将少量硝酸银溶液滴入氨水中:Ag++2NH3?H2O═[Ag(NH3)2]++2H2O |
| D、碳酸氢钠溶液中加入过量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.生成盐酸和HClO,HClO在离子反应中保留化学式;
B.使SO42-恰好完全沉淀,反应生成硫酸钡和偏氯酸钾;
C.反应生成银氨溶液;
D.碳酸氢钠完全反应,生成碳酸钙、水、NaOH.
B.使SO42-恰好完全沉淀,反应生成硫酸钡和偏氯酸钾;
C.反应生成银氨溶液;
D.碳酸氢钠完全反应,生成碳酸钙、水、NaOH.
解答:
解:A.氯气与水反应的离子反应为Cl2+H2O?H++Cl-+HClO,故A错误;
B.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故B错误;
C.将少量硝酸银溶液滴入氨水中的离子反应为Ag++2NH3?H2O═[Ag(NH3)2]++2H2O,故C正确;
D.碳酸氢钠溶液中加入过量的石灰水的离子反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误;
故选C.
B.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故B错误;
C.将少量硝酸银溶液滴入氨水中的离子反应为Ag++2NH3?H2O═[Ag(NH3)2]++2H2O,故C正确;
D.碳酸氢钠溶液中加入过量的石灰水的离子反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、与量有关的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
20℃的纯水的pH和80℃的纯水的pH相比较( )
| A、前者大 | B、后者大 |
| C、相等 | D、无法判断 |
下列有关溶液组成的描述合理的是( )
| A、常温下在c(H+)═1×10-13mol/L的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3- |
| B、酸性溶液中可能大量存在Na+、ClO?、SO42?、I? |
| C、弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? |
| D、无色溶液中可能大量存在K+、AlO2-、NO3-、HCO3- |
下列关于钠的氧化物叙述中正确的是( )
| A、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
| B、Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2 |
| C、Na2O有强还原性,Na2O2有强氧化性 |
| D、Na2O2可作供氧剂,而Na2O不能 |
不能用有关胶体的观点解释的现象是( )
| A、在河流人海口处易形成三角洲 |
| B、在NaHCO3溶液中滴入CaCl2溶液,看不到沉淀 |
| C、少许FeCl3饱和溶液逐滴滴入沸水中,看不到红褐色沉淀 |
| D、同一支钢笔,同时使用不同牌号的墨水易发生堵塞 |
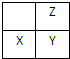 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质质量为( )
| A、184g | B、186g |
| C、212g | D、224g |